Piel y mucosas (barreras superficiales)
En los mamíferos, la piel y las mucosas constituyen barreras protectoras complejas que protegen contra infecciones y lesiones.
OBJETIVOS DE APRENDIZAJE
Describir cómo la piel y las mucosas sirven como barrera protectora que protege contra infecciones y lesiones.
CONCLUSIONES CLAVE
Puntos clave
- La piel está formada por la epidermis, la dermis y la membrana basal.
- La epidermis es la capa más externa de la piel y forma una barrera protectora sobre la superficie del cuerpo. Sus capas crecen continuamente hacia afuera a medida que las capas más viejas se desprenden.
- La dermis está debajo de la epidermis y está hecha de tejido conectivo que protege al cuerpo del estrés y la tensión. Contiene mecanorreceptores, vasos sanguíneos y glándulas sudoríparas.
- Las mucosas son revestimientos cubiertos de epitelio que participan en la absorción y secreción. Forran cavidades que están expuestas al ambiente externo y órganos internos.
- El sistema inmunológico de barrera es parte del sistema inmunológico innato y consiste en todo lo que la piel, las mucosas y las secreciones químicas del cuerpo hacen para evitar la invasión de patógenos.
- El sistema de barrera puede fallar cuando la piel se rompe o cuando los patógenos invaden el epitelio de la mucosa, por lo que existen otras funciones innatas y adaptativas del sistema inmunológico para destruir patógenos en estos casos.
Términos clave
- membranas mucosas : epitelio especializado para estructuras internas y semi-internas que generalmente secreta moco y proporciona alguna función de barrera al sistema inmunológico.
- barrera del sistema inmunológico : Un componente del sistema inmunológico innato que se refiere a las barreras físicas y químicas que evitan que los patógenos entren e infecten el cuerpo.
La piel es una de las partes más importantes del cuerpo porque interactúa con el medio ambiente y es la primera línea de defensa frente a factores externos. Si bien realiza una amplia gama de funciones, incluida la sensación, la regulación del calor, el control de la evaporación, el almacenamiento, la síntesis, la absorción y la resistencia al agua, su sistema inmune innato funciona como la barrera del sistema inmune que son las más críticas.
En los seres humanos, la cubierta exterior del cuerpo está formada por la piel y las mucosas, que juntas forman la barrera del sistema inmunológico.
Componentes de la piel
La piel está formada por varias capas que juntas protegen el cuerpo, regulan la temperatura, mantienen el agua dentro del cuerpo y tienen una función sensorial. La piel es el órgano más grande del cuerpo y consta de tres componentes que difieren mucho en estructura y función:
- La epidermis comprende las capas más externas de la piel. Forma una barrera protectora sobre la superficie del cuerpo, responsable de mantener el agua en el cuerpo y evitar la entrada de patógenos. Está compuesto por tejidos epiteliales escamosos estratificados, compuestos por queratinocitos suprabasales basales y diferenciados en proliferación que forman una matriz extracelular que se divide continuamente a medida que se desprenden las capas externas más antiguas de la epidermis. La epidermis también ayuda a la piel a regular la temperatura corporal a través de los poros sudoríparos que se conectan a las glándulas sudoríparas subyacentes en la dermis.
- La membrana basal es una fina lámina de fibras llamada membrana basal que separa la dermis y la epidermis. Controla el tráfico de células y moléculas entre la dermis y la epidermis y la liberación de citocinas y factores de crecimiento durante la cicatrización de heridas.
- La dermis es la capa de piel debajo de la epidermis que consiste en tejido conectivo y protege al cuerpo del estrés y la tensión. La dermis proporciona fuerza y elasticidad a la piel a través de una matriz extracelular compuesta por fibrillas de colágeno, microfibrillas y fibras elásticas, incrustadas en proteoglicanos. Alberga muchos mecanorreceptores (terminaciones nerviosas sensoriales) que proporcionan las sensaciones del tacto y el calor. También contiene folículos pilosos, glándulas sudoríparas, glándulas sebáceas, glándulas apocrinas, vasos linfáticos y vasos sanguíneos. Los vasos sanguíneos de la dermis nutren y eliminan los desechos de sus propias células y de la epidermis.
Membranas mucosas
Las membranas mucosas (o mucosas; mucosa singular) son revestimientos de origen principalmente endodérmico, cubiertos por varios tipos de epitelio, que participan en la absorción y secreción. Forran cavidades que están expuestas al ambiente externo y órganos internos. Se adhieren a la piel de las fosas nasales, la boca, los labios, los párpados y el área genital, pero también se encuentran dentro de las cavidades corporales, como el estómago, el ano, la tráquea y las orejas.
La mayoría de las membranas mucosas secretan un líquido espeso y pegajoso llamado moco, que facilita varias funciones de barrera del sistema inmunológico y proporciona un ambiente húmedo para las estructuras internas y semi-internas. Las mucosas están altamente especializadas en cada órgano para hacer frente a diferentes afecciones. La mayor variación se observa en el epitelio. En el esófago y la orofaringe, el epitelio está estratificado, escamoso y no queratinizante, para proteger estas áreas de los alimentos ásperos o ácidos. En el estómago es columnar y está organizado en fosas y glándulas gástricas para secretar ácidos y pepsina. El epitelio del intestino delgado está especializado para la absorción, organizado en un epitelio columnar simple sobre vellosidades protuberantes con criptas estrechas que tienen una gran superficie. El epitelio mucoso de la nasofaringe está pseudoestratificado y ciliado,
La barrera del sistema inmunológico
Juntas, la piel y las mucosas forman la barrera del sistema inmunológico, técnicamente considerado un componente del sistema inmunológico innato. Estas estructuras forman barreras físicas a la infección que evitan que los patógenos ingresen al cuerpo a través de una variedad de métodos. Si bien la piel simplemente evita la entrada de patógenos, las estructuras más especializadas, como la escalera mecánica mucociliar en la tráquea, atrapan a los patógenos en las secreciones de moco y usan los cilios para expulsarlos de la tráquea y evitar la entrada a los pulmones.
El sistema de barrera también incluye barreras químicas que evitan la entrada de patógenos. Los ejemplos notables incluyen la acidez del estómago que mata a la mayoría de los microbios, los péptidos antimicrobianos en el tejido epitelial de la mucosa e incluso el flujo de orina que elimina los patógenos de la uretra.
El sistema de barrera es la primera línea de defensa contra la invasión de patógenos, aunque no es perfecto. La piel puede romperse a través de cortes o abrasiones que exponen el torrente sanguíneo al medio ambiente. No todos los patógenos se capturan ni se inhiben en el moco y algunos pueden infectar directamente el epitelio de la mucosa. El tabaquismo y el abuso de alcohol dañan la escalera mecánica muciliar y facilitan que los patógenos invadan los pulmones. Afortunadamente, otros mecanismos del sistema inmunológico innato y adaptativo defienden al cuerpo cuando falla el sistema de barrera.
Dermis : vista esquemática de una sección de piel.
Fagocitos
Los fagocitos son los glóbulos blancos que protegen el cuerpo al ingerir partículas extrañas dañinas y ayudan a iniciar una respuesta inmune.

OBJETIVOS DE APRENDIZAJE
Describir los tipos de fagocitos y sus funciones en el inicio de una respuesta inmune.
CONCLUSIONES CLAVE
Puntos clave
- Muchos glóbulos blancos y otras células del cuerpo utilizan la fagocitosis para engullir y destruir células.
- La fagocitosis ocurre en varios pasos, que incluyen unirse a un patógeno opsonizado con un receptor y matarlo mediante una explosión oxidativa.
- Los monocitos son fagocitos que pueden diferenciarse en macrófagos y células dendríticas según las condiciones del cuerpo.
- Los macrófagos son el equipo de limpieza del sistema inmunológico innato. Eliminan escombros, patógenos y neutrófilos muertos después de una respuesta inflamatoria.
- Los neutrófilos son
granulocitos polimorfonucleares (PMN) que son los primeros en responder a una respuesta inflamatoria. Matan a los patógenos mediante fagocitosis y desgranulación, pero mueren como resultado. - Los mastocitos son granulocitos PMN circulatorios que desencadenan una respuesta inmune al liberar un mediador inflamatorio cuando detectan un antígeno con sus receptores de tipo toll.
Términos clave
- explosión oxidativa : reacción química que ocurre en los fagocitos en la que un patógeno sumergido es destruido por la exposición al estrés oxidativo de especies reactivas de oxígeno.
- Granulocito PMN : tipo de fagocito que contiene gránulos de PMN, sobre todo neutrófilos y mastocitos, pero también basófilos y eosinófilos.
Cualquier célula que se someta a fagocitosis, un proceso en el que los patógenos y otras partículas extrañas y detritos son engullidos por una célula para ser destruidos, se considera un fagocito. La mayoría de los fagocitos son tipos de glóbulos blancos que utilizan la fagocitosis para realizar la función básica del sistema inmunológico innato dentro del cuerpo.
El mecanismo de la fagocitosis
La fagocitosis es el proceso por el cual un fagocito engulle un patógeno o escombros. Puede ocurrir en casi cualquier tejido, con mayor frecuencia en el torrente sanguíneo y el espacio intersticial, pero también en los alvéolos de los pulmones y el parénquima de la mayoría de los demás órganos principales del cuerpo. La fagocitosis típica ocurre en el transcurso de algunos pasos:
- Un receptor en la membrana celular del fagocito se une a una partícula extraña, como un microbio patógeno o una toxina. El receptor Fc es típicamente el receptor de uso, que se une a anticuerpos que han opsonizado (marcado) un patógeno o toxina.
- El citoplasma rodea y envuelve al patógeno unido a través de endocitosis.
- El patógeno envuelto se mantiene en una vacuola llamada fagosoma, que luego se une a los lisosomas dentro de la célula.
- Se produce una serie de reacciones químicas llamadas explosión oxidativa, que utiliza especies reactivas de oxígeno y NADPH oxidasa para dañar y matar al patógeno a través del estrés oxidativo. El estrés oxidativo puede matar una célula a través del ADN, la membrana celular o daño mitocondrial.
- Los restos del patógeno son expulsados por exocitosis.
Estos son los mecanismos generales usados por la fagocitosis para engullir y matar patógenos, pero pueden ocurrir algunas variaciones. Por ejemplo, se pueden usar otros receptores para engullir patógenos, y existen otros métodos no oxidativos (como la lisozima) para matar el patógeno fagocitado.
Tipos de fagocitos
Hay muchas clases de fagocitos dentro del cuerpo, cada uno con diferentes funciones especializadas que involucran la fagocitosis. La mayoría de los fagocitos se derivan de las células madre de la médula ósea. Los principales tipos de fagocitos son los monocitos, macrófagos, neutrófilos, células dendríticas tisulares y mastocitos. Otras células, como las células epiteliales y los fibroblastos, también pueden participar en la fagocitosis, pero carecen de receptores para detectar patógenos opsonizados y no son principalmente células del sistema inmunológico.
Monocitos
Los monocitos se desarrollan en la médula ósea y alcanzan la madurez en la sangre. Los monocitos maduros tienen núcleos grandes, lisos y lobulados y un citoplasma abundante que contiene gránulos, pero técnicamente no se consideran granulocitos. Los monocitos ingieren sustancias extrañas o peligrosas y presentan antígenos a otras células del sistema inmunológico. Los monocitos forman dos grupos: un grupo circulante y un grupo marginal que permanece en otros tejidos (aproximadamente el 70% están en el grupo marginal). La mayoría de los monocitos abandonan el torrente sanguíneo después de 20 a 40 horas para viajar a los tejidos y órganos; durante este proceso, se diferencian en macrófagos o células dendríticas según las señales que reciben.
Macrófagos
Los macrófagos maduros se derivan de monocitos, células madre de granulocitos o la división celular de macrófagos preexistentes. Los macrófagos no tienen gránulos, pero contienen muchos lisosomas. Se encuentran en todo el cuerpo en casi todos los tejidos y órganos, pero rara vez se encuentran en el torrente sanguíneo. Los macrófagos causan inflamación a través de la producción de interleucina-1, interleucina-6 y TNF-alfa. Los macrófagos se activan de varias formas, incluidas las células T, citocinas como IFN-gamma o compuestos derivados de patógenos como las toxinas LPS de bacterias. Durante la inflamación, entran unas 72 horas después de la respuesta inicial para limpiar los escombros y los neutrófilos muertos.
Células dendríticas
Las células dendríticas son células presentadoras de antígenos especializadas que tienen excrecencias largas llamadas dendritas, que ayudan a engullir microbios y otros invasores. Expresan moléculas MHC de clase II, lo que las convierte en la célula presentadora de antígenos ideal. Las células dendríticas están presentes en los tejidos que están en contacto con el medio externo, principalmente la piel, el revestimiento interno de la nariz, los pulmones, el estómago y los intestinos.
Una vez activadas, maduran y migran a los tejidos linfoides, donde presentan antígenos a las células T y B para iniciar la respuesta inmune adaptativa. Esto implica derivar células T y B que son específicas para un solo antígeno a partir de linfocitos ingenuos.
Neutrófilos
Los neutrófilos son un tipo de granulocito PMN que normalmente se encuentra en el torrente sanguíneo. Son el tipo de fagocito más abundante y el primero en responder durante la inflamación. Una vez que han recibido las señales de quimiocinas adecuadas, los neutrófilos abandonan el torrente sanguíneo y llegan al sitio de una infección adhiriéndose al endotelio vascular para introducirse en los tejidos. Allí, engullen rápidamente a los invasores cubiertos de anticuerpos, células dañadas o restos celulares. También se degranulan para liberar perforina, granzima, proteasas y otras sustancias químicas que causan daño citotóxico a los patógenos (y ocasionalmente también a los tejidos corporales normales). Los neutrófilos mueren después de la fagocitosis, convirtiéndose en pus que luego es limpiado por los macrófagos.
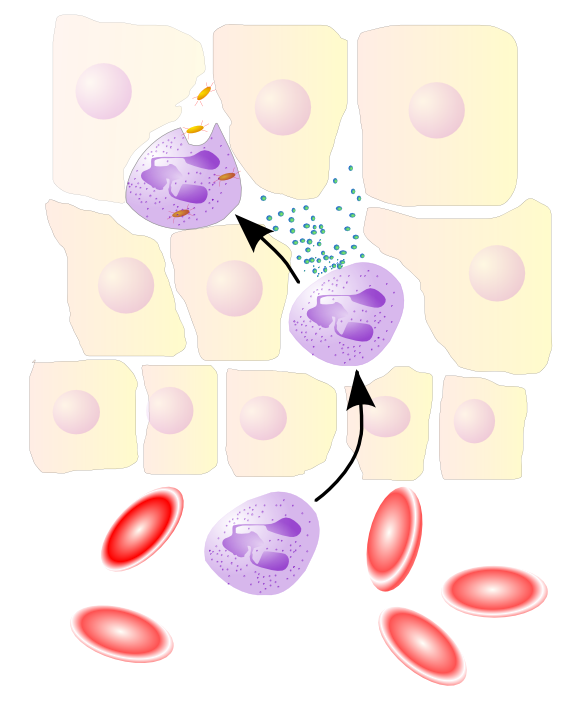
Mastocitos
Los mastocitos son granulocitos PMN con receptores tipo toll que tienden a desencadenar respuestas inflamatorias. Los mastocitos expresan moléculas MHC de clase II y pueden participar en la presentación de antígenos; sin embargo, no se comprende bien el papel de los mastocitos en la presentación de antígenos. Los mastocitos pueden consumir, matar y procesar sus antígenos. Además de estas funciones, los mastocitos producen citoquinas que se mantienen en sus gránulos, como la histamina, que inducen una respuesta inflamatoria cuando se detecta un patógeno. Debido a esta función, las respuestas inflamatorias alérgicas ocurren cuando un mastocito se sensibiliza a un antígeno al que normalmente no reaccionaría.
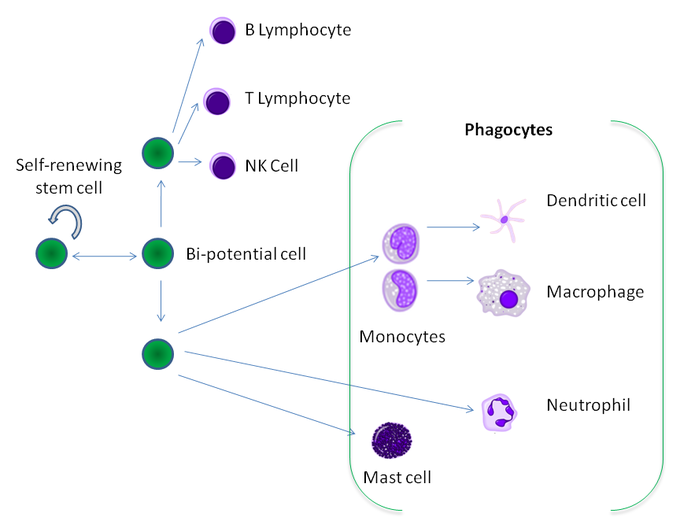
Diferenciación de leucocitos : los fagocitos se derivan de las células madre en la médula ósea. Los monocitos se diferencian en células dendríticas y macrófagos, mientras que los mastocitos y los neutrófilos también se encuentran en un grupo separado de granuolcitos de PMN.
Células asesinas naturales
Las células asesinas naturales (NK) son linfocitos citotóxicos fundamentales para el sistema inmunológico innato.
OBJETIVOS DE APRENDIZAJE
Describir el papel de las células asesinas naturales en el sistema inmunológico innato.
CONCLUSIONES CLAVE
Puntos clave
- Las células NK se diferencian de las células progenitoras de los linfocitos y son una parte fundamental del sistema inmunológico innato.
- Las células NK reconocen células anormales o infectadas con receptores activadores y receptores inhibidores.
- Todas las células normales del cuerpo expresan MHC I para indicar que esas células son parte del cuerpo.
- Los receptores inhibidores reconocen los alelos del MHC de clase I, lo que inhibe la respuesta de destrucción de NK y explica por qué las células NK matan a las células que poseen pocas o ninguna molécula de MHC de clase I.
- Los receptores activadores reconocen antígenos, anticuerpos u otras opsoninas en la superficie de una célula y activan una respuesta de muerte.
- Las células NK son citotóxicas; pequeños gránulos en su citoplasma contienen proteínas como la perforina y proteasas conocidas como granzimas que desencadenan la apoptosis o la lisis celular en una célula anormal.
- Las células NK pueden liberar dos potentes citocinas del sistema inmunológico, IFN-gamma y TNF-alfa, cuando se activan ciertos receptores.
Términos clave
- Complejo principal de histocompatibilidad I : molécula que se expresa en las células para indicar a las células del sistema inmunitario que son células normales del cuerpo de ese organismo. Abreviado como MHC I.
- apoptosis : respuesta en la que una célula sufre una muerte celular programada y su ADN y otros componentes se destruyen por completo. Es un mecanismo para detener las infecciones virales y el desarrollo del cáncer y es el resultado del estrés celular.
Las células asesinas naturales (NK) son linfocitos citotóxicos fundamentales para el sistema inmunológico innato. El papel de las células NK es similar al de las células T citotóxicas en la respuesta inmune adaptativa. Las células NK proporcionan respuestas rápidas a las células infectadas por virus y responden a la formación de tumores mediante la destrucción de células anormales e infectadas. Las células NK utilizan la apoptosis mediada por gránulos citolíticos para destruir células anormales e infectadas.
Descripción general de asesino natural
Normalmente, las células inmunes detectan el complejo mayor de histocompatibilidad (MHC) presentado en la superficie celular, lo que desencadena la liberación de citocinas y la lisis o apoptosis en células que no expresan MHC I o que lo expresan mucho menos que las células normales. A diferencia de los fagocitos, las células NK no necesitan que sus objetivos sean opsonizados (marcados) por anticuerpos antes de que puedan actuar, lo que permite una reacción inmunitaria mucho más rápida. Sin embargo, las opsoninas aceleran el proceso.
Estas células se denominaron “asesinos naturales” porque se pensaba que funcionaban sin activación de citocinas o quimiocinas. Sin embargo, investigaciones posteriores demostraron que las citocinas juegan un papel en la guía de las células NK hacia las células estresadas que pueden necesitar ser destruidas.
Las células NK son linfocitos granulares grandes derivados de las células progenitoras linfoides comunes (linfoblastos), que también generan linfocitos B y T. Las células NK se diferencian y maduran en la médula ósea, los ganglios linfáticos, el bazo, las amígdalas y el timo, donde luego ingresan al torrente sanguíneo.
Reconocimiento MHC I
Para que las células NK defiendan al cuerpo contra virus y patógenos, necesitan mecanismos para determinar si una célula está infectada. Los mecanismos exactos siguen siendo el tema de la investigación actual, pero se cree que está involucrado el reconocimiento de un estado del “yo alterado”. Para controlar su actividad citotóxica, las células NK poseen dos tipos de receptores de superficie: receptores activadores y receptores inhibidores. La mayoría de estos receptores también están presentes en ciertas células T. Estos receptores reconocen el complejo principal de histocompatibilidad I (MHC I), una molécula que se expresa en cada célula para indicar que la célula pertenece al cuerpo.
Cuando la célula NK reconoce MHC I en una célula usando un receptor inhibidor, se inhibe su respuesta de destrucción. Cuando la célula NK no reconoce el MHC I en la célula con un receptor inhibidor, o detecta un antígeno con un receptor activador, se activa la respuesta de destrucción. Las células infectadas por virus y los patógenos extraños, como bacterias y hongos, no expresarán el MHC I específico del organismo huésped, lo que no inhibirá las respuestas de destrucción de las células NK. Si se estimulan ambos tipos de receptores, el receptor que experimente un mayor grado de estimulación relativa determinará el comportamiento de las células NK. Algunas células tumorales aún pueden expresar MHC I en cantidades bajas, por lo que pueden evadir la destrucción de las células NK en función del equilibrio de los estímulos activadores e inhibidores.

Mecanismos de citotoxicidad
Los gránulos de las células NK contienen proteínas como perforina y proteasas conocidas como granzimas. Al unirse a una célula programada para la muerte, la perforina forma poros en la membrana celular de la célula diana, creando un canal acuoso a través del cual las granzimas y moléculas asociadas pueden ingresar, induciendo apoptosis o lisis celular osmótica (una forma de necrosis celular). Las defensinas, un antimicrobiano secretado por las células NK, mata directamente a las bacterias al alterar sus paredes celulares.
La apoptosis es una forma de “muerte celular programada” en la que la célula es estimulada por los mecanismos citotóxicos para autodestruirse. A diferencia de la lisis, la apoptosis no degrada el ADN y las células se destruyen limpia y completamente por sí mismas. La lisis celular causa necrosis de esa célula, en la que el ADN y los componentes celulares se degradan en detritos que deben ser fagocitados por macrófagos. Esta distinción tiene muchas implicaciones importantes. Las células infectadas por virus destruidas por lisis celular liberan sus partículas de virus replicadas en el cuerpo, que infecta a otras células. En la apoptosis, estas partículas de virus se destruyen. Sin embargo, las células cancerosas a menudo desarrollan mecanismos genéticos para evitar que se produzcan señales de apoptosis, por lo que la lisis celular suele ser más eficaz.
Las células osponizadas con anticuerpos son más fáciles de detectar y destruir para las células NK. Los receptores FcϒRIII (CD16) (un tipo de receptor activador) pueden reconocer los anticuerpos que se unen a los antígenos, lo que da como resultado la activación de NK, la liberación de gránulos citolíticos y la consiguiente apoptosis celular.
Citocinas en la actividad de las células NK
Las citocinas juegan un papel en la activación de las células NK. Muchas células liberan citocinas como resultado del estrés celular cuando se infectan con un virus. Las citocinas involucradas en la activación de NK incluyen IL-12, IL-15, IL-18, IL-2 y CCL5. Las células NK se activan en respuesta a interferones o citocinas derivadas de macrófagos. Sirven para contener infecciones virales mientras que la respuesta inmune adaptativa genera células T citotóxicas específicas de antígeno que pueden eliminar la infección.
Las células NK también secretan sus propias citocinas para ayudar a facilitar las respuestas inmunitarias, generalmente tras la activación de las células NK. Las células NK funcionan para controlar las infecciones virales secretando IFNγ (interferón gamma) y TNFα (factor de necrosis tumoral alfa). El IFNγ activa los macrófagos para la fagocitosis y la lisis, mientras que el TNFα actúa para promover la muerte directa de las células tumorales NK. También es un potente mediador inflamatorio que provoca respuestas inflamatorias duraderas y fiebre en respuesta a infecciones más graves. Los pacientes con deficiencia de células NK demuestran ser más susceptibles a la mayoría de las infecciones que las personas con niveles normales de células NK, debido a la pérdida de la función y la eficiencia del sistema inmunológico innato.
Inflamación
La inflamación es parte de la respuesta biológica de los tejidos vasculares a los estímulos dañinos.
OBJETIVOS DE APRENDIZAJE
Describir los mecanismos biológicos de la inflamación y su papel en la inmunidad innata.
CONCLUSIONES CLAVE
Puntos clave
- La inflamación aguda se produce debido a una infección, lesión o irritación y es una parte esencial del proceso de curación para eliminar los patógenos y comenzar el proceso de curación de la herida.
- Durante la inflamación, se produce vasodilatación, el endotelio se vuelve más permeable a medida que el exudado se filtra hacia los tejidos y los neutrófilos migran al sitio de la inflamación.
- La inflamación aguda es iniciada por células que ya están presentes en todos los tejidos, como los mastocitos que reconocen patrones moleculares asociados a patógenos (PAMP) con receptores tipo toll, pero otras células como las células asesinas naturales (NK) también pueden desencadenar inflamación.
- La inflamación aguda se caracteriza por dolor, enrojecimiento, inmovilidad (pérdida de función), hinchazón y calor.
- Los neutrófilos migran a los tejidos inflamados rodando sobre el endotelio con selectinas, adhiriéndose a él con integrinas y deslizándose a través de sus espacios con PECAM-1. Luego siguen las quimiocinas a los tejidos para encontrar patógenos que destruir.
- Los episodios repetidos de inflamación aguda conducen a una inflamación crónica, un proceso de curación constante y daño inducido por la inflamación, ya que el problema inicial nunca se cura realmente.
- Las reacciones alérgicas son el resultado de una respuesta inmune inapropiada que desencadena la inflamación.
Términos clave
- extravasion:
- exudado : edema rico en proteínas causado por proteínas que fluyen hacia los tejidos durante la inflamación debido al aumento de la permeabilidad vascular y la presión oncótica.
- mediador inflamatorio : cualquier sustancia química liberada por las células que estimula la vasodilatación y el aumento de la permeabilidad que se producen durante la inflamación aguda.
La inflamación es parte de la compleja respuesta biológica de los tejidos vasculares a los estímulos dañinos, como patógenos, lesiones o traumatismos e irritantes. La inflamación es un intento protector del organismo para eliminar los estímulos nocivos e iniciar el proceso de curación. La inflamación no es sinónimo de infección, incluso en los casos en que la inflamación es causada por una infección. Más bien, se refiere a la respuesta del cuerpo para tratar de combatir la infección. Si bien la inflamación es un mecanismo importante de la inmunidad innata, puede dañar al organismo en casos de alergia, autoinmunidad e infecciones en tejidos con poca capacidad regenerativa como el corazón.
Funciones y componentes de la respuesta inflamatoria
La función principal de la inflamación es desencadenar una respuesta inmunitaria en un área del cuerpo que la necesita para combatir los patógenos que pueden causar una infección o ayudar a curar una lesión. Los principales síntomas de la inflamación aguda son hinchazón, enrojecimiento, dolor, pérdida de función y calor. Siempre ocurren tres componentes de la respuesta inflamatoria aguda básica: vasodilatación, aumento de la permeabilidad vascular y migración de leucocitos a los tejidos afectados.
Vasodilatación
Una respuesta inflamatoria puede ser causada por cualquiera de los numerosos mediadores inflamatorios liberados por las células del sistema inmunológico innato. Los mediadores a corto plazo más comunes son la histamina y la serotonina de los mastocitos, pero la bradicinina, las proteínas del complemento, algunas interleucinas, las prostaglandinas y el TNF-alfa también pueden desencadenar la inflamación de otros tipos de células. Los mastocitos circulantes contienen receptores tipo toll, que pueden detectar patrones moleculares asociados a patógenos (PAMPS) en la superficie de patógenos y liberar un mediador inflamatorio como la histamina en respuesta. Alternativamente, los mastocitos pueden liberar mediadores inflamatorios debido a las señales de las células dañadas (que liberarán factores de coagulación) durante un traumatismo o lesión.
Después de que se libera un mediador inflamatorio en el torrente sanguíneo, se produce un período de vasoconstricción transitoria, que dura solo unos pocos segundos. Luego, los vasos sanguíneos se expanden para experimentar vasodilatación por el estímulo del mediador inflamatorio vasoactivo, lo que aumenta el flujo sanguíneo al área. Esto provoca una disminución y estasis de los glóbulos rojos, lo que puede estar involucrado en la respuesta de coagulación necesaria para detener el sangrado en caso de lesión. La vasodilatación es la causa del enrojecimiento, el calor y el dolor asociados con la inflamación.
Mayor permeabilidad vascular
El siguiente paso de la inflamación aguda es un aumento de la permeabilidad vascular debido a la actividad mediadora inflamatoria, que hace que los vasos sanguíneos se vuelvan más permeables. Normalmente, solo el agua y los compuestos pequeños pueden salir del torrente sanguíneo hacia los tejidos, pero durante la inflamación, las proteínas grandes del torrente sanguíneo, como las albúminas séricas, pueden filtrarse hacia los tejidos. El agua sigue a estas proteínas debido a la fuerza de presión oncótica que ejercen las proteínas. A esto se le llama exudado, una forma de edema. A medida que el exudado se acumula dentro de los tejidos, se inflaman. El exudado puede transportar proteínas y anticuerpos antimicrobianos a los tejidos y estimula el drenaje linfático.
Migración de leucocitos a los tejidos
El siguiente paso de la respuesta inflamatoria aguda es la migración de neutrófilos por quimiotaxis al área afectada. Los neutrófilos son reclutados en el sitio de la inflamación por diversas citocinas. Otros mediadores inflamatorios, como TNF-alfa e IL-1, aumentan la expresión de moléculas de adhesión en las células endoteliales vasculares. Los neutrófilos se adhieren libremente a las células endoteliales mediante el uso de selectinas, un proceso llamado balanceo . Luego, las integrinas se adhieren firmemente a las moléculas de adhesión de las células endoteliales, lo que se denomina adhesión. Juntos, el enrollamiento y la adhesión se conocen como marginación , la acumulación de leucocitos en el endotelio.
El siguiente paso es que los neutrófilos se aprieten a través de los espacios en el endotelio hacia los tejidos mediante la unión con PECAM-1 expresado en el endotelio, un proceso llamado extravasión . Luego, los neutrófilos siguen un gradiente quimiotáctico hasta el sitio de la infección de la lesión en los tejidos, donde desgranularán y fagocitarán los patógenos. Más tarde, los macrófagos ingresan a los tejidos a través de un proceso similar para limpiar los neutrófilos muertos y los desechos celulares.
Resultados de la inflamación aguda
Inflamación : dedos de los pies inflamados por sabañones
Cuando finaliza la inflamación aguda (típicamente por la liberación de mediadores antiinflamatorios como IL-10 o el final de la liberación de mediadores inflamatorios) se producirá una resolución si se alivia el problema. La resolución implica respuestas fisiológicas que son parte del proceso de curación, como la curación de heridas. Si el problema no se resuelve, puede volver a producirse una inflamación aguda. Los episodios repetidos de inflamación aguda, conocida como inflamación crónica, conducen a un cambio progresivo en el tipo de células presentes en el sitio de la inflamación y se caracterizan por la destrucción y curación simultáneas del tejido del proceso inflamatorio. En particular, la fibrosis (cicatrización) y la necrosis tisular son resultados comunes de la inflamación crónica.
Proteínas Antimicrobianas
Los péptidos antimicrobianos son un componente conservado evolutivamente de la respuesta inmune innata que se encuentra entre todas las clases de vida.
OBJETIVOS DE APRENDIZAJE
Describir el papel de los péptidos antimicrobianos en el sistema inmunológico innato.
CONCLUSIONES CLAVE
Puntos clave
- Los péptidos antimicrobianos incluyen una carga neta positiva y extremos hidrófilos e hidrófobos, que les permiten adherirse a las membranas lipídicas de las membranas celulares bacterianas.
- La carga positiva hace que los péptidos antimicrobianos sean selectivos, por lo que solo se adhieren a las membranas de las células bacterianas cargadas negativamente en lugar de a las membranas de las células huésped.
- Los modos de acción mediante los cuales los péptidos antimicrobianos matan a las bacterias son variados e incluyen alterar las membranas, interferir con el metabolismo y dirigirse a los componentes citoplasmáticos.
- Muchas bacterias han desarrollado resistencia a los antimicrobianos, en la que se altera un componente de sus membranas celulares o secreciones enzimáticas para evitar que los péptidos se unan a las bacterias, o inhibiendo los péptidos directamente.
Términos clave
- Resistencia a los antimicrobianos : cualquier mecanismo que permita a las bacterias evadir o inhibir la acción antimicrobiana.
- péptido : Una clase de compuestos orgánicos que consta de varios números de aminoácidos en los que la amina de uno reacciona con el ácido carboxílico del siguiente para formar un enlace anamida.
- anfipático : Molécula con grupos tanto hidrófobos como hidrófilos que le permiten adherirse a las estructuras lipídicas con mayor facilidad.
Los péptidos antimicrobianos (también llamados péptidos de defensa del huésped) son un componente conservado evolutivamente de la respuesta inmune innata que se encuentra entre todas las especies conocidas. Estos péptidos se encuentran en muchas de las membranas mucosas del cuerpo humano y, por lo tanto, se consideran parte de la barrera del sistema inmunológico. La función de estos péptidos es matar patógenos microbianos y evitar que ingresen al cuerpo.
Estructura
Los péptidos antimicrobianos son un grupo de moléculas único y diverso. Como péptidos, están formados por cadenas de aminoácidos que determinan su composición y estructura. Estos péptidos tienen una carga positiva más fuerte que la negativa, que es un componente importante de su selectividad. También incluyen grupos hidrófobos e hidrófilos que les permiten adherirse a otras moléculas (a menudo lípidos) a través de fuerzas intermoleculares, como la bicapa lipídica que forma las membranas celulares.
Las estructuras secundarias de estas moléculas siguen cuatro temas, que incluyen i) α-helicoidal, ii) β-hebra debido a la presencia de dos o más enlaces disulfuro, iii) β-horquilla o bucle debido a la presencia de un solo enlace disulfuro y / o ciclación de la cadena peptídica, y iv) prolongada. Muchos de estos péptidos no están estructurados e inactivos en solución libre y se pliegan en su configuración final al llegar a las membranas mucosas. La anfipaticidad (extremos hidrófilos e hidrófobos) y la carga positiva de los péptidos son sus características estructurales definitorias.
Acción antimicrobiana
Los modos de acción por los cuales los péptidos antimicrobianos matan a las bacterias son variados e incluyen alterar las membranas celulares, interferir con el metabolismo y dañar los orgánulos. El contacto inicial entre el péptido y el organismo objetivo es electrostático debido a la fuerza de la carga iónica negativa y positiva. La composición de aminoácidos, la anfipaticidad, la carga catiónica y el tamaño les permiten adherirse e insertarse en las bicapas de la membrana para formar poros mediante mecanismos de duela de barril, alfombra o poros toroidales.
Los péptidos son selectivos y, por tanto, es más probable que se adhieran a las membranas celulares bacterianas que a las membranas celulares de las células huésped. Los péptidos tienen una carga positiva mayor que la carga negativa, mientras que las membranas de las células bacterianas tienen una carga negativa mayor que las membranas de las células huésped. Esto hace que el péptido se una a las membranas bacterianas en lugar de a las membranas de la célula huésped.

Mecanismo de selectividad de los péptidos antimicrobianos : las membranas celulares de las bacterias son diferentes de las membranas celulares de las plantas y los animales y se dirigen preferentemente a las proteínas antimicrobianas.
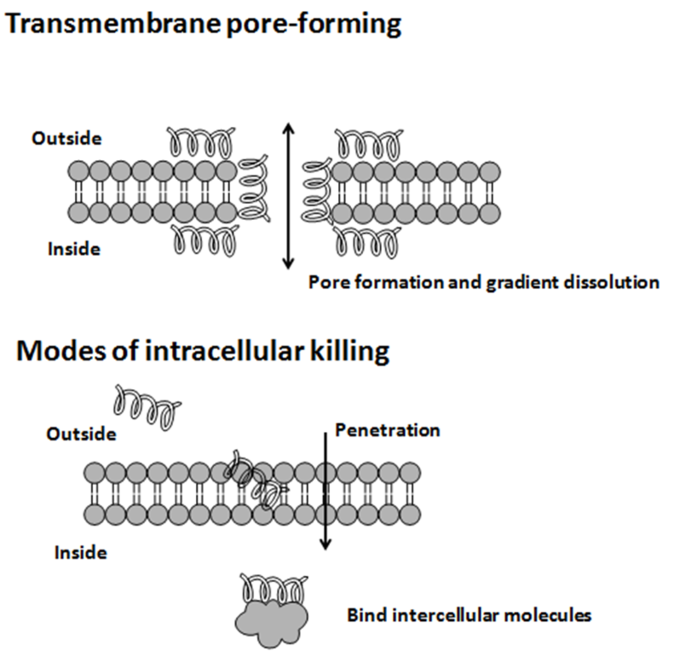
Otros mecanismos antimicrobianos incluyen modelos de unión intracelular. Estos incluyen la inhibición de la síntesis de la pared celular, la alteración de la membrana citoplásmica, la activación de la autolisina, la inhibición de la síntesis de ADN, ARN y proteínas, y la inhibición de ciertas enzimas bacterianas. Sin embargo, en muchos casos, se desconoce el mecanismo de muerte exacto. En general, la actividad antimicrobiana de estos péptidos se determina midiendo la concentración inhibitoria mínima (MIC), la concentración más baja de fármaco que inhibe el crecimiento bacteriano y un indicador de la fuerza antimicrobiana de ese péptido.
Resistencia antimicrobiana
A pesar de la eficacia de los péptidos antimicrobianos para inhibir y matar bacterias, aún pueden ingresar al cuerpo y causar infecciones. Las bacterias pueden desarrollar resistencia a los péptidos antimicrobianos (así como resistencias separadas a los antibióticos y otros antimicriobianos). Bacterias como Staphylococcus aureas , que forma la cepa MRSA altamente resistente, pueden reducir la negatividad de la carga de su membrana celular al llevar aminoácidos del citoplasma a su membrana celular para que los péptidos antimicrobianos no se unan a él. Otras formas de resistencia a los antimicrobianos incluyen la producción de enzimas que inhiben los péptidos antimicrobianos, la alteración de las fuerzas hidrofóbicas en la membrana celular y la captura de péptidos antimicrobianos en vesículas en la membrana celular para eliminarlos de la bacteria.
Además, las bacterias comensales han desarrollado resistencia antimicrobiana a los péptidos, pero son la flora normal del cuerpo. La mayoría nunca actúa como patógeno, aunque algunos pueden ser patógenos oportunistas o solo actúan como patógenos en personas con ciertas características genéticas.
Fiebre
La fiebre es una elevación de la temperatura corporal por encima del punto de ajuste regulatorio, mediada por la liberación de prostaglandina E2.
OBJETIVOS DE APRENDIZAJE
Describir cómo la fiebre, un síntoma común de enfermedades, es inducida por pirógenos endógenos y exógenos.
CONCLUSIONES CLAVE
Puntos clave
- En última instancia, la temperatura se regula en el hipotálamo. Un desencadenante de la fiebre, llamado pirógeno, provoca la liberación de prostaglandina E2 (PGE2). A continuación, la PGE2 actúa sobre el hipotálamo, lo que eleva el punto de ajuste de la temperatura de modo que la temperatura corporal aumenta a través de la generación de calor y la vasoconstricción.
- La fiebre puede ser útil como respuesta inmune innata para combatir infecciones al matar bacterias y virus.
- La aspirina es un potente fármaco contra la fiebre porque inhibe la producción de COX-2, que inhibe la liberación de PGE2.
- Un pirógeno es una sustancia que induce fiebre y puede ser interna (endógena) o externa (exógena) al cuerpo.
- Durante las infecciones graves, la fiebre puede ser más dañina que útil, ya que las células del cuerpo se dañan además de las células bacterianas, lo que puede causar más problemas para que el sistema inmunológico innato los maneje.
Términos clave
- pirógeno : cualquier sustancia que produzca fiebre o un aumento de la temperatura corporal a través de la vía del ácido araquidónico.
- Vía del ácido araquidónico : Vía por la cual la prostaglandina E-2, un regulador de la fiebre, y varios mediadores inflamatorios son producidos por la actividad pirógena con fospolípidos y COX-2, generalmente en el cerebro o el hígado.
La fiebre (también conocida como pirexia) es un proceso fisiológico de la respuesta inmune innata contra muchas infecciones y enfermedades, que se caracteriza por una elevación de la temperatura por encima del rango normal de 36,5 a 37,5 ° C (98 a 100 ° F) debido a un aumento de el punto de ajuste regulador de la temperatura corporal. Aunque la temperatura de la persona aumenta, a menudo hay una sensación de frío. Una vez que se alcanza la nueva temperatura, hay una sensación de calor. La fiebre puede ser causada por muchas afecciones que van desde benignas hasta potencialmente graves. La fiebre es útil para combatir las infecciones, pero también puede causar daños en el cuerpo.
Vías de la fiebre
En última instancia, la temperatura se regula en el hipotálamo. El principal mediador de la fiebre en el cuerpo humano es la prostaglandina E2 (PGE2), que actúa sobre el hipotálamo para elevar el punto de ajuste de temperatura. La liberación de PGE2 proviene de la vía del ácido araquidónico, que también produce mediadores inflamatorios como el tromboxano y los leucotrienos.
Esta vía está mediada por las enzimas fosfolipasa A2 (PLA2), ciclooxigenasa-2 (COX-2) y prostaglandina E2 sintasa. En última instancia, estas enzimas median en la síntesis y liberación de PGE2. Por lo tanto, los inhibidores de COX-2, como la aspirina, se usan comúnmente para reducir la fiebre, aunque los tratamientos diseñados para inhibir los pirógenos también son efectivos.
El hipotálamo es el termostato del cuerpo, ya que altera el punto de ajuste de temperatura durante la retroalimentación de temperatura y la fiebre. Durante la fiebre, el punto de ajuste se eleva, lo que hace que el cuerpo aumente su temperatura a través de la generación y retención de calor de forma activa (vasoconstricción). Si estas medidas son insuficientes para hacer que la temperatura de la sangre en el cerebro coincida con la nueva configuración en el hipotálamo, entonces comienzan a temblar para que esos movimientos musculares produzcan más calor. Cuando cesa la fiebre (cuando termina la liberación de PGE2), el punto de ajuste de la temperatura se reduce a la normalidad y se utilizan los procesos inversos (vasodilatación, fin de los escalofríos y producción de calor sin escalofríos), así como la sudoración, para enfriar el cuerpo al máximo. nuevo ajuste más bajo.
Pirógenos
Un pirógeno es una sustancia que induce fiebre y puede ser interna (endógena) o externa (exógena) al cuerpo. La pirogenicidad puede variar: en ejemplos extremos, los pirógenos bacterianos conocidos como superantígenos pueden causar fiebres rápidas y peligrosas. La despirogenación se puede lograr mediante filtración, destilación, cromatografía o inactivación.
La toxina lipopolisacárido de factores exógenos (de bacterias gram negativas) que puede activar una serie de vías de activación inmune innatas. Estas vías inducen la expresión de pirógenos endógenos, que incluyen una variedad de citocinas como IL1α, IL1β, IL6, TNFα, TNFβ, IFNα, INFβ e INFγ. Por ejemplo, si una célula NK detecta lipopolisacárido de un patógeno, liberará TNFα, que viajará a través del torrente sanguíneo para inducir una serie de cambios inflamatorios de larga duración, incluida la fiebre. Cuando el TNFα o cualquiera de estos factores de citocina se unen a las células de los fospolípidos del cerebro, se activa la vía del ácido araquidónico y se libera PGE2 para actuar sobre el hipotálamo y provocar la respuesta febril.
Problemas de fiebre
La fiebre es normalmente un proceso inmunológico beneficioso ya que el aumento de la temperatura corporal puede matar bacterias y virus y desnaturalizar las enzimas bacterianas. Pero cuando la temperatura corporal sube demasiado, la fiebre suele ser más dañina que útil. Las fiebres altas también desnaturalizan las propias proteínas del cuerpo, lo que puede alterar el metabolismo celular normal, provocando lesiones celulares y la muerte. La temperatura corporal elevada y persistente también puede desencadenar la apoptosis. Los tratamientos para las fiebres severas incluyen antipirógenos y aspirina, que también ayudan a detener los coágulos de sangre que pueden coincidir con fiebre severa.
Las fiebres altas (más de 104 grados Fahrenheit) son un síntoma de infecciones graves. Si bien las fiebres generalmente no son la causa directa de muerte en estos casos, tienden a empeorar el pronóstico. Por ejemplo, el choque séptico es una infección bacteriana grave en la que las toxinas bacterianas estimulan el pirógeno y la actividad mediadora inflamatoria provoca fiebre alta. La fiebre hace que sea más difícil para el cuerpo detener la falla orgánica sistémica que ocurre por los mecanismos compensatorios en el choque séptico. Los órganos fallan cuando se les extrae sangre para combatir la infección (mecanismos compensatorios), el daño causado por la fiebre da como resultado una actividad aún más del mecanismo compensatorio. Si bien el choque séptico es uno de los peores ejemplos posibles de fiebre, ilustra un concepto importante en fisiopatología: que las funciones inmunes normales pueden dañarnos con la misma facilidad que ayudarnos.