Extractado de: Aluminum Vaccine Adjuvants: Are they Safe? PMID: 21568886 DOI: 10.2174/092986711795933740
L. Tomljenovic *1 y C.A. Shaw *2
*1 Post-doctoral fellow, Neural Dynamics Research Group, Department of Ophthalmology and Visual Sciences, University of British Columbia, 828 W. 10th Ave, Vancouver, BC, V5Z 1L8, Canada
*2 Professor, Departments of Ophthalmology and Visual Sciences and Experimental Medicine and the Graduate Program in Neuroscience, University of British Columbia, Vancouver, British Columbia, 828 W. 10th Ave, Vancouver, BC, V5Z 1L8, Canada
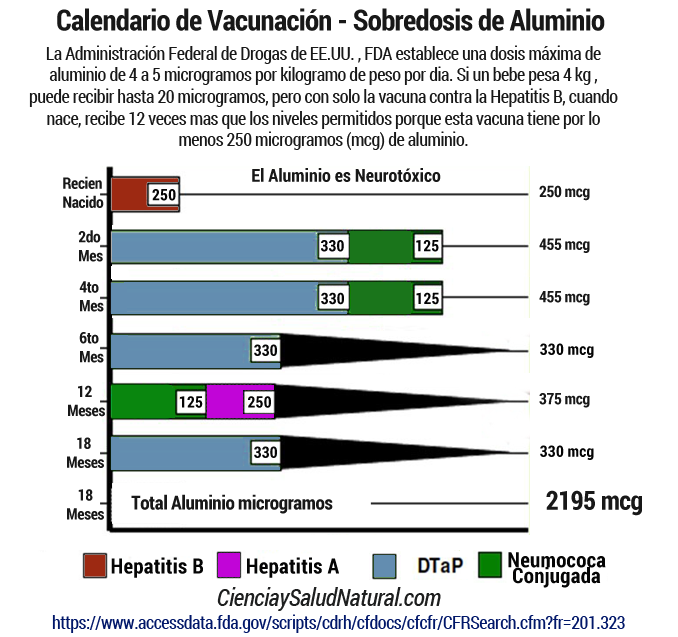
La Administración de Drogas y Alimentos de EE.UU. FDA establece una dosis máxima de aluminio de 4 a 5 microgramos por kilogramo de peso por dia. Si un bebe pesa 4 kg , puede recibir hasta 20 microgramos, pero con solo la vacuna contra la Hepatitis B, cuando nace, recibe 12 veces mas que los niveles permitidos porque esta vacuna tiene por lo menos 250 microgramos (mcg) de aluminio.
Las dosis de adyuvantes de aluminio recibidos por los niños aumentaron dramáticamente a medida que el calendario de vacunación se amplió en los años 1980 y 1990. Sin embargo, la seguridad de las dosis crecientes de adyuvantes de aluminio no fue probada. Las agencias gubernamentales (HHS, NIH, CDC, FDA) no han hecho ningún nuevo trabajo experimental sobre la toxicidad del adyuvante de aluminio. Para justificar la seguridad de los adyuvantes de aluminio con las dosis más altas de hoy en día, el Centro de Control de Enfermedades, CDC, que son los que establecen los Calendarios de Vacunación en varios paises del mundo, se basa en un estudio de modelado teórico con fallas significativas (Mitkus 2011). Hay una deficiente evidencia científica que apoya la seguridad de los adyuvantes de aluminio y ningún interés de los CDC en investigar como se debería.

SOBRE EL ALUMINIO
El aluminio (Al) es una neurotoxina demostrada experimentalmente y el adyuvante de vacuna más utilizado. A pesar de casi 90 años de uso generalizado de adyuvantes de aluminio, la comprensión de la ciencia médica sobre sus mecanismos de acción sigue siendo deficiente. [1, 2, 3, 4, 5, 6]. También existe una preocupante escasez de datos sobre toxicología y farmacocinética de estos compuestos. A pesar de esto, la noción de que
El aluminio en las vacunas no es seguro la investigación experimental, muestra claramente que los adyuvantes de aluminio tienen el potencial de inducir trastornos inmunológicos graves en humanos [5-8] . En particular, el aluminio en forma adyuvante conlleva un riesgo de autoinmunidad, inflamación cerebral a largo plazo y complicaciones neurológicas asociadas y, por lo tanto, pueden tener profundas y generalizadas consecuencias adversas para la salud.
Las preocupaciones sobre la seguridad de los adyuvantes de aluminio es evidente a partir de las conclusiones resumidas en el Taller de aluminio en vacunas realizado en Puerto Rico en 2000 [2].
El consenso escrito entre los participantes del taller figuraba bajo la rúbrica de “incertidumbre generalizada”, un término utilizado
para denotar lo que permaneció desconocido con respecto al aluminio potencial toxicidad de los adyuvantes. Las áreas específicas de preocupación fueron:
- “1) toxicología y farmacocinética, específicamente el procesamiento de aluminio por infantes y niños,
- 2) mecanismos por los cuales los adyuvantes de aluminio interactúan con el sistema inmune y
- 3) el necesidad de adyuvantes en dosis de refuerzo “.
El informe afirmaba que “El uso de sales de aluminio como adyuvantes en las vacunas ha demostrado ser seguro y efectivo “[2]. Esta afirmación sigue siendo cuestionable. Dado que múltiples vacunas con adyuvante de aluminio a menudo se administran a niños muy pequeños (es decir, recién nacidos y de 2 a 6 meses de edad), en un solo día en sesiones de vacunación individual [9, 10], preocupaciones por el potencial los impactos de la carga corporal total de aluminio derivado del adyuvante pueden ser
significativo [11, 12]. Estas cuestiones merecen una consideración seria
ya que, hasta donde sabemos, no se han realizado estudios adecuados
realizado para evaluar la seguridad de la administración simultánea de
diferentes vacunas para niños pequeños. Otro tema de preocupación es
la falta de cualquier evaluación toxicológica sobre concomitante
administración de aluminio con otros compuestos tóxicos conocidos
que son componentes de rutina de las preparaciones comerciales de vacunas, por ejemplo, formaldehído, formalina, mercurio, fenoxietanol, fenol, borato de sodio, polisorbato 80, glutaraldehído [13, 14]. A pesar de
todo esto, los adyuvantes de aluminio generalmente se consideran seguros [2, 13], y algunos investigadores incluso han recomendado que ya no lo son más. Los esfuerzos de investigación deben dedicarse a este tema a pesar de “la falta de evidencia de buena calidad ”[15].
TOXICIDAD DE ALUMINIO EN ANIMALES Y HUMANOS
El aluminio es una toxina bien demostrada en los sistemas biológicos
[16] cuyos impactos más específicos sobre el sistema nervioso han sido
ampliamente documentado (Tabla 1). Ya en 1911, el Dr. William Gies
había resumido datos de 7 años de pruebas experimentales en humanos y animales sobre los efectos del consumo oral de sales de aluminio, luego utilizadas principalmente en polvos de hornear, alimentos preservación y fabricación de tintes [17]. El resultado de estos los estudios llevaron a Gies a concluir que: “el uso en alimentos de aluminio o cualquier otro compuesto de aluminio es una práctica peligrosa “. Gies” las preocupaciones han sido confirmadas por estudios experimentales
mostrando que la exposición oral al aluminio que está en niveles “típicamente” consumido en una “dieta occidental” promedio durante un período prolongado de tiempo, produce resultados sorprendentemente similares en roedores a aquellos inducida por inyección intracerebral de sales de aluminio (Tabla 1) con la excepción de las incautaciones y muertes [18, 19]. Animales intoxicados con aluminio dietético muestra rutinariamente un rendimiento deteriorado en tareas de aprendizaje y memoria, disminución de la concentración y cambios de comportamiento que incluyen confusión y comportamientos repetitivos [18, 19].
De acuerdo con el Informe toxicológico elaborado para aluminio preparado por la Agencia de Sustancias Tóxicas y Registro de Enfermedades (ATSDR):
“Existe una base de datos bastante extensa sobre la toxicidad oral de
aluminio en animales. Estos estudios identifican claramente como el sistema nervioso es el blanco más sensible de la toxicidad del aluminio”[16].
En humanos, la toxicidad del aluminio se ha relacionado sólidamente con
síndrome de encefalopatía asociada a diálisis, también conocido como
demencia de diálisis. Este síndrome ocurre en pacientes con falla renal sometida a tratamiento de diálisis crónica y es causada por acumulación de aluminio administrado por vía intravenosa del fluido de diálisis (que se deriva del agua del grifo tratada con aluminio) [20]). La demencia de diálisis se asocia con niveles anormalmente altos de plasma y aluminio en el cerebro y generalmente es fatal de 3 a 7 meses después de la manifestación manifiesta repentina de síntomas clínicos en pacientes que habían estado en tratamiento de diálisis durante 3 a 7 años [21, 22] (a menos que se trate con un agente quelante como la desferrioxamina (DFO) o la ósmosis inversa para eliminar las sales de aluminio del agua utilizada para preparar el líquido de diálisis [20-23]). Los síntomas aparecen repentinamente y empeoran durante o inmediatamente después de una sesión de diálisis [21, 22, 24-26]. El primer síntoma que aparece es una anomalía del habla, luego temblores, control psicomotor alterado, pérdidas de memoria, concentración alterada, cambios de comportamiento, ataques epilépticos, coma y muerte [20-22, 24-26]. Aunque también se pensaba que la ingestión frecuente de medicamentos que contenían aluminio era un factor contribuyente en la demencia de diálisis [26], cabe señalar que no hubo incidencias de este síndrome antes de la introducción de sales de aluminio en los suministros de agua [21, 27]. Además, los pacientes sintomáticos mejoraron rápidamente cuando se hicieron esfuerzos para eliminar el aluminio del líquido de diálisis, a pesar de que todavía ingirieron grandes cantidades de geles de unión a fosfato que contienen aluminio [21]. Además de la demencia de diálisis, una serie de complicaciones y enfermedades neurodegenerativas como el Alzheimer [11, 28], la enfermedad de Parkinson [29], la esclerosis lateral amiotrófica (ELA) [29], la esclerosis múltiple [30], el síndrome de la Guerra del Golfo (GWS) [5, 6], el autismo [31] y la epilepsia [12] también pueden estar relacionados con la exposición al aluminio. Si bien es probable que estas enfermedades sean de etiologías multifactoriales, el aluminio ciertamente tiene el potencial de servir como cofactor tóxico.
EXPOSICIÓN AL ALUMINIO DE LAS VACUNAS: CARGAS Y RIESGOS EN EL CUERPO
Durante el transcurso de los últimos 30 años, el número de vacunas oficialmente programadas que se consideran necesarias para los niños. Ha aumentado considerablemente, de 10 en la década de 1980 a 32 a fines de la década de 2000, 18 de las cuales contienen adyuvantes de aluminio [11]. El tema de la seguridad de la vacuna se vuelve aún más grave dado que, no se han realizado estudios clínicos específicos para establecer la seguridad de la administración concomitante de dos neurotoxinas establecidas experimentalmente, aluminio y mercurio, este último en forma de etil mercurio (timerosal) en bebés y niños. Dado que estas moléculas afectan negativamente muchos de los mismos procesos bioquímicos y enzimas implicados en la etiología del autismo, el potencial de una acción tóxica sinérgica es plausible [31, 47].
El Aluminio no puede ser usado como placebo
Además, con el propósito de evaluar la seguridad y la eficacia, los ensayos clínicos de vacunas a menudo usan un placebo que contiene aluminio, ya sea que contenga la misma o mayor cantidad de aluminio que la vacuna de prueba [48-51]. Sin excepción, estos ensayos informan una tasa comparable de reacciones adversas entre el placebo y el grupo de vacuna (por ejemplo, 63.7% vs 65.3% de eventos sistémicos y 1.7% vs 1.8% de eventos adversos graves respectivamente [51]). Según la Administración de Drogas y Alimentos de los Estados Unidos (FDA), un placebo es “una píldora, líquido o polvo inactivo que no tiene valor de tratamiento” [52]. Por lo tanto, las propiedades neurotóxicas bien establecidas del aluminio identificaron que el aluminio no puede constituir un placebo válido.
En 1965, Klatzo et al. [38] demostraron que el fosfato de aluminio, el componente principal del adyuvante de Holt, puede inducir la degeneración y los cambios histológicos neurofibrilares en forma de maraña en las neuronas (una característica distintiva de la enfermedad de Alzheimer), cuando se inyectaba intracerebralmente en conejos . Los animales inyectados con aluminio también sufrieron convulsiones [38]. Si bien la aplicación directa de adyuvantes de aluminio al sistema nervioso central (SNC) es indudablemente neurotóxica [37, 38, 40, 42], se sabe poco sobre el transporte de aluminio dentro y fuera del SNC, su toxicocinética y el impacto en diferentes subpoblaciones neuronales. después de inyecciones subcutáneas o intramusculares. La razón de esto es que según las políticas reguladoras actuales, la evaluación de las propiedades farmacocinéticas no es necesario para las vacunas [53]. Este tema es de especial preocupación en el contexto de las prácticas mundiales de inmunización masiva que involucran a niños cuyos sistemas nerviosos están experimentando un desarrollo rápido. Además, una barrera hematoencefálica inmadura en desarrollo (BBB) es más permeable a las sustancias tóxicas que la de un adulto [16, 54]. Además, en el desarrollo neurológico crítico que ocurre dentro de los primeros años de vida postnatal durante los cuales la exposición a las lesiones neurotóxicas puede inducir daño al SNC [16, 47, 55]. Cualquier daño potencial al SNC tratado por el aluminio en los niños no puede ser evidente hasta una etapa posterior de desarrollo [16].
Obispo y col. [32] han detectado que, la exposición parenteral a un solo 20 µg / kg pc de aluminio durante> 10 días puede dar lugar a resultados perjudiciales a largo plazo en el desarrollo neurológico en los recién nacidos prematuros.
En 2004, la Administración de Drogas y Alimentos de los EE. UU. (FDA) problemas un límite para el aluminio de fuentes parenterales para personas con insuficiencia renal y recién nacidos prematuros a no más de 4 a 5 µg / kg pc / día, indicando que los niveles superiores a esos se han asociado con el SNC y la toxicidad ósea [56]. Además, según la FDA, la carga de tejido puede variar a niveles de administración aún más bajos [56]. Se desconoce lo que es el límite superior para la exposición al aluminio “seguro” para los recién nacidos sanos.
En una revisión reciente, Offit y Jew [3], al abordar las preocupaciones sobre la posible toxicidad adyuvante del aluminio, citaron como evidencia un estudio de alimentación no controlada por Golub et al. [61], que utilizó lactato de aluminio como forma de tratamiento. Los revisores declararon que: “No se observaron reacciones adversas cuando los ratones se alimentaron con cantidades de aluminio tan altas como 62 mg / kg / día” [3], cuando en realidad el 20% de los ratones mostraron una actividad motora significativamente menor [61]. Además, Golub et al. [61] enfatizó que: “La clara influencia de la dieta Al (Aluminio) en la actividad motora sugiere el valor de realizar más pruebas de animales alimentados con Al en áreas de competencia sensorial-motriz, así como en el funcionamiento cognitivo y social”. A menudo, los investigadores tienen dificultades de considerar [3, 13] es el hecho de que diferentes compuestos de aluminio pueden variar en su potencial tóxico o que el grado de toxicidad de un compuesto en particular depende de una ruta específica de administración, la duración de la exposición y las especies estudiadas. Por ejemplo, mientras se alimenta de hidróxido de aluminio a 66.5, 133 y
266 mg de Al / kg / día para ratones no parece causar daño en el desarrollo neurológico [62, 63], la administración parenteral de cloruro de aluminio a 40 mg / kg / día causa muertes maternas en ratas, así como letalidad embrionaria, retraso del crecimiento y fetal anormalidades [64]. También se demostró que estos últimos efectos ocurren a dosis más bajas (20 mg / kg / día [64]). Un estudio riguroso de la literatura primaria muestra además que la evidencia de neurotoxicidad pre, perinatal y posnatal del aluminio está bien establecida [65-71], incluso a dosis muy bajas de aluminio. Por ejemplo, Gonda et al. [72] han demostrado que la exposición parenteral durante los días de gestación 7 a 15 a tan solo 2,5,5 y 10 mg / kg / día de lactato de aluminio da como resultado un rendimiento disminuido y una latencia alargada en la respuesta de evitación en crías de rata. La evidencia de toxicidad potencial de aluminio en la vida temprana está, por lo tanto, más firmemente establecida que la sugerida por algunos investigadores [3, 13, 15].
Finalmente, el aluminio administrado por vía parenteral tiene más relevancia para la exposición a la vacuna que el aluminio dietético. En este contexto, vale la pena señalar que, a diferencia del aluminio en la dieta, del cual solo el 0.25% se absorbe en la circulación sistémica [73], el aluminio de las vacunas puede absorberse con una eficiencia de casi el 100% [74]. También es importante tener en cuenta que el aluminio iónico no tendrá las mismas propiedades toxicocinéticas que el aluminio unido a un antígeno. Si bien el aluminio iónico se puede excretar a través de los riñones, los tamaños de la mayoría de los complejos antígeno-aluminio (24-83 kDa [59, 75, 76]) son más altos que el límite de peso molecular del glomérulo (~ 18 kDa [12 ]), lo que probablemente excluye la excreción eficiente de estos compuestos. De hecho, la excreción efectiva obviaría la razón básica por la que se usan adyuvantes. Por todas estas razones, el aluminio derivado de la vacuna tiene un potencial mucho mayor para inducir daño neurológico que el obtenido a través de la dieta, incluso en aquellos con función renal efectiva. Además, el aluminio adyuvante puede obtener acceso al SNC como lo demuestran Redhead et al. [77], quienes mostraron que la inyección intraperitoneal de vacunas adsorbidas en aluminio en ratones causó un aumento transitorio en los niveles de aluminio en el tejido cerebral que alcanzaron su punto máximo al segundo y tercer día después de la inyección.
TOXICOQUINÉTICA DEL ALUMINIO: DESARROLLO DEL CEREBRO
Los experimentos de Levy et al. [78] y otros estudios existentes disponibles sobre la farmacocinética de los adyuvantes de aluminio sugieren que estos compuestos pueden acceder a la circulación sistémica y cruzar la barrera hematoencefálica. Flarend y col. [79] estimó la absorción de aluminio en conejos hembras adultas después de la inyección intramuscular de dos formas de adyuvantes marcados con Al, hidróxido de aluminio y fosfato de aluminio. Los resultados mostraron que ambos se absorbieron rápidamente, apareciendo en la sangre tan pronto como una hora después de la inyección [79]. Los niveles sanguíneos de aluminio se mantuvieron elevados durante 28 días después de la inyección en ambos casos y el análisis tisular posterior reveló niveles elevados de aluminio en los riñones, el bazo, el hígado, el corazón, los ganglios linfáticos y, en particular, el cerebro [79]. En el estudio de Flarend et al. [79], el nivel de aluminio en el cerebro era más bajo en comparación con los otros órganos, sin embargo, el estudio de Yumoto et al. [80] indicó que dicho patrón de distribución de tejido puede depender de la edad.
Después de una única inyección subcutánea de Al en el día 15 de gestación, estos investigadores mostraron que el 0.2% del Al inyectado en una rata preñada había sido transferido por vía transplacentaria a los fetos. Notablemente, la cantidad de aluminio radiomarcado en el cerebro fetal fue 30% más alta que en el hígado, mientras que en las represas, los niveles de aluminio en el cerebro fueron solo el 1% de los niveles encontrados en el hígado [80]. La posibilidad de que el cerebro fetal pueda actuar como un sumidero para el aluminio puede ser motivo de preocupación, ya que, en determinadas circunstancias, se recomienda la vacunación de mujeres embarazadas con varias vacunas con aluminio adyuvante (tétanos, hepatitis A y B, meningococo y neumococo [3, 81]) según las directrices actuales de vacunación de los Estados Unidos [82].
EFECTOS ADVERSOS ASOCIADOS A AJUSTES DE ALUMINIO
Un síndrome recientemente descrito denominado miofascitis macrofágica (MMF) se ha atribuido específicamente a adyuvantes de aluminio en receptores de vacunas contra la hepatitis A y B y toxoide tetánico (Td) [83]. Se encontró que los pacientes con MMF padecen artromialgias difusas, fatiga crónica, debilidad muscular y, en algunos casos, esclerosis múltiple [83]. Las biopsias musculares muestran una extensa infiltración de macrófagos y linfocitos reactivos positivos para ácido de Schiff granular y linfocitos y un daño discreto a las fibras musculares [2, 7, 83-85]. Si bien la mayoría de los pacientes con MMF parecían tener un conteo normal de glóbulos blancos, los análisis de laboratorio mostraron evidencia de aumento de la inflamación y la presencia de autoanticuerpos en suero. El primero fue indicado por aumentos significativos en los niveles de citocinas inflamatorias antagonista del receptor de interleucina (IL) -1 e IL-6 [2]. La microscopía electrónica y el análisis microanalítico mostraron que la aparición de lesiones MMF se debió a la persistencia a largo plazo de los adyuvantes de aluminio en el sitio de las inyecciones y las reacciones inmunes locales concomitantes en curso [8, 83]. Se demostró que el aluminio persiste en el sitio de inyección desde varios meses hasta 8 años después de la vacunación [83, 85]. Posteriormente, las lesiones de MMF también se reprodujeron en ratas mediante inyección de adyuvantes de aluminio [86].
Los adyuvantes de aluminio son estimuladores muy potentes del sistema inmune y su acción específica es cambiar la respuesta inmune hacia un perfil Th2. En ese sentido, el Dr. Gherardi, que describió por primera vez MMF, señaló: “Es plausible que la activación inmune sistémica persistente que no se apague represente la base fisiopatológica del síndrome de fatiga crónica asociado con miofasciitis macrofágica, de manera similar a lo que sucede en pacientes con infección postinfecciosa”. Fatiga crónica y posiblemente síndrome de fatiga crónica idiopática ”[8]. Los síntomas de MMF son similares a los del síndrome de la Guerra del Golfo GWS, un trastorno multisistémico que se ha relacionado con múltiples vacunas administradas durante un corto período de tiempo (Tabla 3 [6, 8]). Al igual que con el autismo y el MMF, los pacientes con GWS también muestran predominio de Th2 y un factor de riesgo significativo para causar este síndrome puede ser el adyuvante de hidróxido de aluminio de la vacuna contra el ántrax.
Las inyecciones de hidróxido de aluminio a niveles comparables a los administrados a los veteranos de la Guerra del Golfo causaron una degeneración significativa de las neuronas motoras, así como alteraciones en la función motora y disminuciones en la capacidad de memoria espacial en ratones jóvenes CD-1 machos [43, 44].
Una preocupación aún más grave es que la estimulación persistente de Th2, debido a la administración repetida de vacunas con adyuvante de aluminio, puede tener profundos efectos adversos a largo plazo en el sistema inmune en desarrollo en los niños. Un bebé recién nacido tiene un sistema inmunitario no desarrollado que tiene una función limitada [87] y requiere una serie de desafíos para alcanzar su plena capacidad. Antes de la introducción de las vacunas obligatorias, estos desafíos se debieron principalmente a las enfermedades infantiles relativamente menores, como las paperas y el sarampión. Las vacunas dirigidas a estimular la producción de anticuerpos por el sistema inmune humoral (Th2) ubicado en la médula ósea, evitan el sistema inmune celular (Th1) en las superficies mucosas (tracto respiratorio y gastrointestinal), dejando a este último sin respuesta durante el período crítico de desarrollo. Dado que los progenitores Th1 no se diferenciarán en células Th1 en ausencia de citocinas Th1 [88] (debido a la estimulación crónica de la vía Th2), el resultado final de un cambio prolongado de Th2 puede ser la inmunidad celular (Th1) permanentemente atrofiada. Irónicamente, la inmunidad Th1 es inherentemente mucho más eficiente en la eliminación de patógenos virales que la inmunidad Th2 [6, 88, 89], lo que plantea una pregunta sobre la eficacia general de las vacunas con adyuvante de aluminio en la lucha contra las infecciones virales. En particular, un mecanismo similar por el cual el estrés agudo, subagudo o crónico suprime selectivamente la inmunidad celular (Th1) pero aumenta la inmunidad humoral (Th2), se cree que es responsable del inicio y / o curso de muchas enfermedades infecciosas, autoinmunes / inflamatorias, alérgicas y enfermedades neoplásicas [89]. Por ejemplo, la investigación indica que al inducir un cambio de Th2, las hormonas del estrés pueden aumentar la susceptibilidad a las infecciones respiratorias agudas causadas por los virus de la gripe y mejorar la progresión de la enfermedad en individuos positivos al virus de la inmunodeficiencia humana (VIH) [89]. Además, el estrés agudo severo asociado con una alta producción de adrenalina conduce a la liberación de histamina de las células inmunes de tipo Th2 (mastocitos), que pueden iniciar reacciones alérgicas nuevas o exacerbarlas [89]. Finalmente, se han observado altos niveles de histamina en varios tejidos cancerosos, lo que sugiere que la amplificación de las respuestas Th2 dependiente de la hormona del estrés puede aumentar la susceptibilidad a la tumorigénesis [89]. En conjunto, estas observaciones explican potencialmente por qué la inmunidad adquirida naturalmente contra las enfermedades comunes de la infancia puede proteger contra ciertos tipos agresivos de tumores en humanos [90], asma y otras alergias [91, 92], así como también trastornos neurodegenerativos como el Parkinson [93] .
Aunque la mayoría de las enfermedades autoinmunes están relacionadas con Th1, otras, como los síndromes similares al lupus, están mediadas por las citocinas Th2 IL-10 [89] e IL-4 [95]. Se cree que los adyuvantes de la vacuna pueden desencadenar la autoinmunidad a través de un efecto espectador, al activar las células T autorreactivas latentes en individuos predisponentes [96].
El repertorio de reacciones adversas y síndromes asociados con las vacunas con adyuvante de aluminio coincide al espectro de enfermedades derivadas de la disfunción inmune [5, 6]. Además, se han reportado muertes entre las personas que fueron vacunadas contra la vacuna contra el ántrax. Estos incluyeron muertes por paro cardíaco repentino, infarto de miocardio con poliarteritis nodosa, anemia aplásica, linfoma del SNC[59]. Dado que la vacuna contra el ántrax contiene una dosis más alta de aluminio que la mayoría de las otras vacunas con adyuvante de aluminio (0.6 mg / dosis versus 0.5 mg / dosis de Engerix-B [59, 94]), combinado con otro adyuvante potente y estimulante Th2, el escualeno [6] , no se puede descartar el potencial de acciones adversas sinérgicas por parte de estos dos adyuvantes en humanos.
También se informaron resultados fatales después de la administración de vacunas pediátricas con hexavalentes adyuvantes con aluminio, una de las cuales (Hexavac) se retiró posteriormente del uso, aparentemente debido a su poca efectividad [97]. Zinka y col. [98] informaron seis casos de muerte súbita infantil que ocurrieron dentro de las 48 horas después de la vacunación con vacunas hexavalentes. El análisis post mortem de seis niños de 4 a 17 meses (cinco de los cuales fueron vacunados con Hexavac y uno con Infanrix Hexa) reveló hallazgos patológicos anormales que afectan particularmente al sistema nervioso [98]. Las anomalías patológicas generales incluyeron congestión aguda, BBB defectuosa, infiltración del leptomeninx por macrófagos y linfocitos, infiltración linfocítica perivascular, infiltración difusa de la protuberancia, mesencéfalo y corteza por los linfocitos T, microglia en el hipocampo y la protuberancia, y en un caso, necrosis en el cerebelo [98]. También se encontró un aumento de la triptasa sérica de mastocitos y el número de granulocitos eosinófilos, lo que indica que se desarrolló una reacción anafiláctica posterior a la vacunación [98]. La anafilaxia parece ser un efecto secundario común asociado con las vacunas con adyuvante de aluminio. De acuerdo con Zinka et al. [98], hubo un aumento de 13 veces en la muerte infantil después de la introducción de vacunas hexavalentes en la práctica de inmunización [97]. Aunque no hay pruebas concluyentes de que estas muertes fueron causadas directamente por la vacunación, los autores consideraron que era “importante informar a los médicos y pediatras que vacunan, así como a los padres, sobre tales complicaciones posiblemente fatales después de la aplicación de vacunas hexavalentes” [98]. Finalmente, los hallazgos neuropatológicos de Zinka et al. [98] son consistentes con las propiedades neurotóxicas de los adyuvantes de aluminio. Por ejemplo, como lo demuestran nuestro grupo y otros, el aluminio es una neurotoxina BBB [54, 99] que tiene una propensión a activar la microglia cerebral y aumentar la producción de citocinas inflamatorias, lo que provoca y / o exacerba la inflamación y la excitotoxicidad en el cerebro [ 31, 43, 44, 100-104].
La activación permanente de las respuestas inflamatorias cerebrales ha sido reconocida durante mucho tiempo como un factor en la etiología de muchas enfermedades neurodegenerativas [105], incluida la enfermedad de Alzheimer [106, 107], el autismo [31, 108-110], esclerosis múltiple [30] y demencia de diálisis [111]. En particular, todas estas enfermedades se han relacionado previamente con la exposición al aluminio [12, 21, 28, 30, 31, 107, 111]. El aluminio potencia las respuestas inflamatorias en el cerebro mediante múltiples mecanismos, como la activación de la microglia [31, 44, 100, 101, 107, 112] e inducción de la expresión génica proinflamatoria [107].
Respecto a este último, aluminio desde nanomolar a micromolar bajo
las concentraciones aumentan neuroinflamatorios y proapoptóticos específicos cascadas de señalización, sorprendentemente similares a las observadas en Cerebros de la enfermedad de Alzheimer [104], al impulsar la expresión de un subconjunto de promotores inducibles por estrés en cultivo primario humano células cerebrales [113-115]. Por ejemplo, de 8 genes inducidos regulados al alza en neuronas humanas cultivadas por aluminio de 100 nm, 7 mostraron patrones de expresión similares a los observados en Enfermedad de Alzheimer, incluido el factor inducible por hipoxia (HIF) -1 y factor nuclear (NF) – precursor de proteína amiloide sensible a B (A PP), precursor de IL-1, subunidades NF-B, fosfolipasa citosólica A2 (cPLA2), ciclooxigenasa (COX) -2 y DAXX, un regulador
proteína conocida por inducir apoptosis y reprimir la transcripción [114].
Tanto HIF-1 como NF-B están sobrerregulados en la enfermedad de Alzheimer donde alimentan el ciclo proinflamatorio que conduce a más
exacerbación del estrés oxidativo y la inflamación, que culmina en
muerte neuronal [105, 116]. Tomados en conjunto, estos resultados subrayan El potencial de niveles fisiológicamente relevantes de aluminio para conducir mecanismos genotóxicos característicos de la procesos enfermedad neurodegenerativa [115].
CONCLUSION 1
El aluminio en varias formas puede ser tóxico para el sistema nervioso.
La presencia generalizada en el entorno humano puede ser la base de un
número de trastornos del Sistema Nervioso Central SNC. El uso continuo de adyuvantes de aluminio en varias vacunas para niños, así como en general
en el público puede ser motivo de gran preocupación. En particular, aluminio presentado en este estudio conlleva un riesgo de autoinmunidad a largo plazo inflamación cerebral y complicaciones neurológicas asociadas y puede tener consecuencias a la salud adversa profunda y generalizada. La
seguridad no parece estar firmemente establecida en la literatura científica
y, como tal, esta ausencia puede haber conducido a conclusiones erróneas sobre la importancia de estos compuestos en las etiologías de muchos trastornos neurológicos comunes. Además, el uso continuo de placebos que contienen aluminio los ensayos clínicos de las vacunas pueden haber llevado a una subestimación de la tasa real de resultados adversos asociados con adyuvante de aluminio en vacunas. Una evaluación exhaustiva del conjunto el impacto del aluminio en la salud humana está atrasado. Tal evaluación debe incluir estudios diseñados para determinar los impactos a corto y largo plazo del aluminio en la dieta, así como el potencial impacto en diferentes grupos de edad de exposición al aluminio como adyuvante, solo y en combinación con otras vacunas con sus constituyentes potencialmente tóxicos (p. ej., formaldehído, formalina, mercurio, fenoxietanol, fenol, borato de sodio, polisorbato 80,
glutaraldehído). Hasta que la seguridad de la vacuna pueda ser demostrada exhaustivamente por estudios independientes a largo plazo controlado
que examinen el impacto en el sistema nervioso en detalle. Muchos vacunados, como los que están actualmente recibir inyecciones puede estar en riesgo de complicaciones de salud que exceden los beneficios potenciales que la profilaxis de la vacuna puede proporcionar.
El tema de la seguridad de las vacunas con adyuvante de aluminio es especialmente pertinente a la luz de la legislación que podría exigir
regímenes de vacunación para poblaciones civiles (por ejemplo, la Biodefensa y la Ley de desarrollo de medicamentos y vacunas pandémicas de 2005).
Si el riesgo de protección contra una enfermedad temida supera
el riesgo de toxicidad de su supuesto agente profiláctico es un
pregunta que exige un escrutinio mucho más riguroso de lo que ha sido proporcionado hasta la fecha.
Referencias:
[1] Exley, C.; Siesjo, P.; Eriksson, H. The immunobiology of aluminium
adjuvants: how do they really work? Trends Immunol. 2010, 31(3), 103-109.
[2] Eickhoff, T.C.; Myers, M. Workshop summary. Aluminum in vaccines.
Vaccine. 2002, 20 Suppl 3, S1-4.
[3] Offit, P.A.; Jew, R.K. Addressing parents’ concerns: do vaccines contain
harmful preservatives, adjuvants, additives, or residuals? Pediatrics. 2003,
112(6 Pt 1), 1394-1397.
[4] Cribbs, D.H.; Ghochikyan, A.; Vasilevko, V.; Tran, M.; Petrushina, I.;
Sadzikava, N.; Babikyan, D.; Kesslak, P.; Kieber-Emmons, T.; Cotman,
C.W.; Agadjanyan, M.G. Adjuvant-dependent modulation of Th1 and Th2
responses to immunization with beta-amyloid. Int Immunol. 2003, 15(4),
505-514.
[5] Shoenfeld, Y.; Agmon-Levin, N. ‘ASIA’ – Autoimmune/inflammatory
syndrome induced by adjuvants. J Autoimmun. 2011, 36(1), 4-8.
[6] Israeli, E.; Agmon-Levin, N.; Blank, M.; Shoenfeld, Y. Adjuvants and
autoimmunity. Lupus. 2009, 18(13), 1217-1225.
[7] Exley, C.; Swarbrick, L.; Gherardi, R.K.; Authier, F.J. A role for the body
burden of aluminium in vaccine-associated macrophagic myofasciitis and
chronic fatigue syndrome. Med Hypotheses. 2009, 72(2), 135-139.
[8] Gherardi, R.K. [Lessons from macrophagic myofasciitis: towards definition of a vaccine adjuvant-related syndrome]. Rev Neurol (Paris). 2003, 159(2), 162-164.
[9] Centers for Disease Control and Prevention (CDC). 2010 Child &
Adolescent Immunization Schedules for persons aged 0-6 years, 7-18 years,
and “catch-up schedule” and Past Childhood Immunization Schedules.
http://www.cdc.gov/vaccines/recs/schedules/child-schedule.htm#chgs
(Accessed September 2, 2010).
[10] U.K. Department of Health. Immunisation against infectious disease – “The Green Book”, Part 1 Principles, practices and procedures, Chapter 11:
Immunisation schedule. 2007.
ttp://www.dh.gov.uk/en/Publicationsandstatistics/Publications/Publications
PolicyAndGuidance/DH_079917 (Accessed August 19, 2010).
[11] Tomljenovic, L. Aluminum and Alzheimer’s disease: after a century of
controversy, is there a plausible link? J Alzheimers Dis. 2011, 23(4), 567-
598.
[12] Exley, C. Aluminium and Medicine. In Molecular and Supramolecular
Bioinorganic Chemistry: Applications in Medical Sciences. Merce, A.L.R.;
Felcman, J.; Recio, M.A.L., Eds.; Nova Biomedical Books: New York. 2009,
pp. 45-68.
[13] Eldred, B.E.; Dean, A.J.; McGuire, T.M.; Nash, A.L. Vaccine components
and constituents: responding to consumer concerns. Med J Aust. 2006,
184(4), 170-175.
[14] Centers for Disease Control and Prevention (CDC). Guide to Vaccine
Contraindications and Precautions. http://www.cdc.gov/vaccines/recs/vacadmin/
downloads/contraindications-guide-508.pdf (Accessed November 22,
2010).
[15] Jefferson, T.; Rudin, M.; Di Pietrantonj, C. Adverse events after
immunisation with aluminium-containing DTP vaccines: systematic review
of the evidence. Lancet Infect Dis. 2004, 4(2), 84-90.
[16] Agency for toxic substances and disease registry (ATSDR) Toxicological
profile for aluminum. Atlanta, GA, 2008, pp.1-357.
http://www.atsdr.cdc.gov/toxprofiles/tp22.html (Accessed July 20, 2010).
[17] Gies, W.J. Some objections to the use of alum baking-powder. JAMA. 1911, 57(10), 816-821.
[18] Walton, J.R. A longitudinal study of rats chronically exposed to aluminum at human dietary levels. Neurosci Lett. 2007, 412(1), 29-33.
[19] Walton, J.R. Functional impairment in aged rats chronically exposed to
human range dietary aluminum equivalents. Neurotoxicology. 2009, 30(2),
182-193.
[20] Wills, M.R.; Savory, J. Water content of aluminum, dialysis dementia, and osteomalacia. Environ Health Perspect. 1985, 63, 141-147.
[21] Flendrig, J.A.; Kruis, H.; Das, H.A. Aluminium intoxication: the cause of
dialysis dementia ? Proc Eur Dial Transplant Assoc. 1976, 13, 355-368.
[22] Altmann, P. In Aluminium and Alzheimer’s Disease: The science that
describes the link. Exley, C., Ed.; Elsevier Science: Amsterdam. 2001, pp. 1-
37.
[23] D’Haese, P.C.; Couttenye, M.M.; De Broe, M.E. Diagnosis and treatment of aluminium bone disease. Nephrol Dial Transplant. 1996, 11 Suppl 3, 74-79.
[24] Alfrey, A.C. Dialysis encephalopathy syndrome. Annu Rev Med. 1978, 29, 93-98.
[25] Alfrey, A.C. Dialysis encephalopathy. Kidney Int Suppl. 1986, 18, S53-57.
[26] Alfrey, A.C.; LeGendre, G.R.; Kaehny, W.D. The dialysis encephalopathy
syndrome. Possible aluminum intoxication. N Engl J Med. 1976, 294(4),
184-188.
[27] Rozas, V.V.; Port, F.K.; Easterling, R.E. An outbreak of dialysis dementia
due to aluminum in the dialysate. J Dial. 1978, 2(5-6), 459-470.
[28] Exley, C. Aluminium and Alzheimer’s Disease: The science that describes the link, 1st ed.; Elsevier Science: Amsterdam. 2001.
[29] Perl, D.P.; Moalem, S. Aluminum and Alzheimer’s disease, a personal
perspective after 25 years. J Alzheimers Dis. 2006, 9(3 Suppl), 291-300.
[30] Exley, C.; Mamutse, G.; Korchazhkina, O.; Pye, E.; Strekopytov, S.;
Polwart, A.; Hawkins, C. Elevated urinary excretion of aluminium and iron
in multiple sclerosis. Mult Scler. 2006, 12(5), 533-540.[31] Blaylock, R.L.; Strunecka, A. Immune-glutamatergic dysfunction as a central mechanism of the autism spectrum disorders. Curr Med Chem. 2009, 16(2), 157-170.
[32] Bishop, N.J.; Morley, R.; Day, J.P.; Lucas, A. Aluminum neurotoxicity in
preterm infants receiving intravenous-feeding solutions. N Engl J Med. 1997, 336(22), 1557-1561.
[33] Pivnick, E.K.; Kerr, N.C.; Kaufman, R.A.; Jones, D.P.; Chesney, R.W.
Rickets secondary to phosphate depletion. A sequela of antacid use in
infancy. Clin Pediatr (Phila). 1995, 34(2), 73-78.
[34] Exley, C.; Esiri, M.M. Severe cerebral congophilic angiopathy coincident
with increased brain aluminium in a resident of Camelford, Cornwall, UK. J
Neurol Neurosurg Psychiatry. 2006, 77(7), 877-879.
[35] Bowdler, N.C.; Beasley, D.S.; Fritze, E.C.; Goulette, A.M.; Hatton, J.D.;
Hession, J.; Ostman, D.L.; Rugg, D.J.; Schmittdiel, C.J. Behavioral effects of
aluminum ingestion on animal and human subjects. Pharmacol Biochem
Behav. 1979, 10(4), 505-512.
[36] Sinczuk-Walczak, H.; Szymczak, M.; Razniewska, G.; Matczak, W.;
Szymczak, W. Effects of occupational exposure to aluminum on nervous
system: clinical and electroencephalographic findings. Int J Occup Med
Environ Health. 2003, 16(4), 301-310.
[37] Wisniewski, H.M.; Sturman, J.A.; Shek, J.W. Chronic model of
neurofibrillary changes induced in mature rabbits by metallic aluminum.
Neurobiol Aging. 1982, 3(1), 11-22.
[38] Klatzo, I.; Wisniewski, H.; Streicher, E. Experimental Production of
Neurofibrillary Degeneration. I. Light Microscopic Observations. J
Neuropathol Exp Neurol. 1965, 24, 187-199.
[39] McLachlan, D.R.C.; Dalton, A.J. Alterations in short-term retention,
conditioned avoidance response acquisition and motivation following
aluminum induced neurofibrillary degeneration. Physiol Behav. 1973, 10(5), 925-933.
[40] McLachlan, D.C. Experimental neurofibrillary degeneration and altered electrical activity. Electroencephalogr Clin Neurophysiol. 1973, 35(6), 575- 588.
[41] Pendlebury, W.W.; Beal, M.F.; Kowall, N.W.; Solomon, P.R.
Neuropathologic, neurochemical and immunocytochemical characteristics of aluminum-induced neurofilamentous degeneration. Neurotoxicology. 1988, 9(3), 503-510.
[42] Petit, T.L.; Biederman, G.B.; McMullen, P.A. Neurofibrillary degeneration, dendritic dying back, and learning-memory deficits after aluminum administration: implications for brain aging. Exp Neurol. 1980, 67(1), 152- 162.
[43] Petrik, M.S.; Wong, M.C.; Tabata, R.C.; Garry, R.F.; Shaw, C.A. Aluminum
adjuvant linked to Gulf War illness induces motor neuron death in mice.
Neuromolecular Med. 2007, 9(1), 83-100.
[44] Shaw, C.A.; Petrik, M.S. Aluminum hydroxide injections lead to motor
deficits and motor neuron degeneration. J Inorg Biochem. 2009, 103(11),
1555-1562.
[45] Walton, J.R.; Wang, M.X. APP expression, distribution and accumulation are altered by aluminum in a rodent model for Alzheimer’s disease. J Inorg Biochem. 2009, 103(11), 1548-1554.
[46] Golub, M.S.; Gershwin, M.E.; Donald, J.M.; Negri, S.; Keen, C.L. Maternal
and developmental toxicity of chronic aluminum exposure in mice. Fundam Appl Toxicol. 1987, 8(3), 346-357.
[47] Waly, M.; Olteanu, H.; Banerjee, R.; Choi, S.W.; Mason, J.B.; Parker, B.S.;
Sukumar, S.; Shim, S.; Sharma, A.; Benzecry, J.M.; Power-Charnitsky, V.A.;
Deth, R.C. Activation of methionine synthase by insulin-like growth factor-1
and dopamine: a target for neurodevelopmental toxins and thimerosal. Mol Psychiatry. 2004, 9(4), 358-370.
[48] Villa, L.L.; Costa, R.L.; Petta, C.A.; Andrade, R.P.; Ault, K.A.; Giuliano,
A.R.; Wheeler, C.M.; Koutsky, L.A.; Malm, C.; Lehtinen, M.; Skjeldestad,
F.E.; Olsson, S.E.; Steinwall, M.; Brown, D.R.; Kurman, R.J.; Ronnett,
B.M.; Stoler, M.H.; Ferenczy, A.; Harper, D.M.; Tamms, G.M.; Yu, J.;
Lupinacci, L.; Railkar, R.; Taddeo, F.J.; Jansen, K.U.; Esser, M.T.; Sings,
H.L.; Saah, A.J.; Barr, E. Prophylactic quadrivalent human papillomavirus
(types 6, 11, 16, and 18) L1 virus-like particle vaccine in young women: a
randomised double-blind placebo-controlled multicentre phase II efficacy
trial. Lancet Oncol. 2005, 6(5), 271-278.
[49] Harper, D.M.; Franco, E.L.; Wheeler, C.; Ferris, D.G.; Jenkins, D.; Schuind, A.; Zahaf, T.; Innis, B.; Naud, P.; De Carvalho, N.S.; Roteli-Martins, C.M.; Teixeira, J.; Blatter, M.M.; Korn, A.P.; Quint, W.; Dubin, G. Efficacy of a
bivalent L1 virus-like particle vaccine in prevention of infection with human papillomavirus types 16 and 18 in young women: a randomised controlled trial. Lancet. 2004, 364(9447), 1757-1765.
[50] Verstraeten, T.; Descamps, D.; David, M.P.; Zahaf, T.; Hardt, K.; Izurieta,
P.; Dubin, G.; Breuer, T. Analysis of adverse events of potential autoimmune
aetiology in a large integrated safety database of AS04 adjuvanted vaccines.
Vaccine. 2008, 26(51), 6630-6638.
[51] Garland, S.M.; Hernandez-Avila, M.; Wheeler, C.M.; Perez, G.; Harper,
D.M.; Leodolter, S.; Tang, G.W.; Ferris, D.G.; Steben, M.; Bryan, J.;
Taddeo, F.J.; Railkar, R.; Esser, M.T.; Sings, H.L.; Nelson, M.; Boslego, J.;
Sattler, C.; Barr, E.; Koutsky, L.A. (FUTURE) I Investigators) Quadrivalent
vaccine against human papillomavirus to prevent anogenital diseases. N Engl J Med. 2007, 356(19), 1928-1943.
[52] Food and Drug Administration. Inside Clinical Trials: Testing Medical
Products in People. Last updated May 2009. http://www.fda.gov/Drugs/ResourcesForYou/Consumers/ucm143531.htm
(Accessed April 4, 2011).[53] Sanofi Pasteur MSD Limited. Revaxis: Summary of Product Characteristics. http://www.medicines.org.uk/emc/document.aspx?documentid=15259 (Accessed November 17, 2010).
[54] Zheng, W. Neurotoxicology of the brain barrier system: new implications. J Toxicol Clin Toxicol. 2001, 39(7), 711-719.
[55] Blaylock, R.L. Excitotoxicity: a possible central mechanism in fluoride
neurotoxicity. Fluoride. 2004, 37(4), 264–277.
[56] Food and Drug Administration (FDA) Department of Health and Human Services. Aluminum in large and small volume parenterals used in total parenteral nutrition, amendment June 2003, pp. 74.
http://edocket.access.gpo.gov/cfr_2005/aprqtr/pdf/21cfr201.323.pdf
(Accessed August 23, 2010).
[57] Public Health Agency of Canada. Immunization Schedules for Infants and Children, source: Canadian Immunization Guide, Seventh Edition. 2006. http://www.phac-aspc.gc.ca/im/is-cv/ (Accessed September 2, 2010).
[58] Australian Government Department of Health and Aging. National
Immunisation Program (NIP) Schedule. http://immunise.health.gov.au/internet/immunise/publishing.nsf/Content/nips 2 (Accessed September 2, 2010).
[59] Bioport Corp. Anthrax Vaccine Adsorbed (Biothrax™), product monograph. 2002, pp. 1-7. http://www.fda.gov/OHRMS/DOCKETS/98fr/05n-0040- bkg0001.pdf (Accessed September 2, 2010).[60] Haddad, S.; Restieri, C.; Krishnan, K. Characterization of age-related
changes in body weight and organ weights from birth to adolescence in
humans. J Toxicol Environ Health A. 2001, 64(6), 453-464.
[61] Golub, M.S.; Donald, J.M.; Gershwin, M.E.; Keen, C.L. Effects of aluminum ingestion on spontaneous motor activity of mice. Neurotoxicol Teratol. 1989, 11(3), 231-235.
[62] Domingo, J.L.; Gomez, M.; Bosque, M.A.; Corbella, J. Lack of
teratogenicity of aluminum hydroxide in mice. Life Sci. 1989, 45(3), 243-
247.
[63] Domingo, J.L.; Gómez, M.; Colomina, M.T. Risks of aluminium exposure
during pregnancy. Contrib Sci. 2000, 1(4), 479-487.
[64] Benett, R.W.; Persaud, T.V.; Moore, K.L. Experimental studies on the
effects of aluminium on pregnancy and fetal development. Anat Anz. 1975,
138, 365-378.
[65] Bernuzzi, V.; Desor, D.; Lehr, P.R. Developmental alternations in offspring of female rats orally intoxicated by aluminum chloride or lactate during gestation. Teratology. 1989, 40(1), 21-27.
[66] Clayton, R.M.; Sedowofia, S.K.; Rankin, J.M.; Manning, A. Long-term
effects of aluminium on the fetal mouse brain. Life Sci. 1992, 51(25), 1921-
1928.
[67] Rankin, J.; Sedowofia, K.; Clayton, R.; Manning, A. Behavioural effects of gestational exposure to aluminium. Ann Ist Super Sanita. 1993, 29(1), 147- 152.
[68] Poulos, B.K.; Perazzolo, M.; Lee, V.M.; Rudelli, R.; Wisniewski, H.M.;
Soifer, D. Oral aluminum administration during pregnancy and lactation
produces gastric and renal lesions in rat mothers and delay in CNS
development of their pups. Mol Chem Neuropathol. 1996, 29(1), 15-26.
[69] Alleva, E.; Rankin, J.; Santucci, D. Neurobehavioral alteration in rodents following developmental exposure to aluminum. Toxicol Ind Health. 1998, 14(1-2), 209-221.
[70] Llansola, M.; Minana, M.D.; Montoliu, C.; Saez, R.; Corbalan, R.; Manzo,
L.; Felipo, V. Prenatal Exposure to Aluminum Reduces Expression of
Neuronal Nitric Oxide Synthase and of Soluble Guanylate Cyclase and
Impairs Glutamatergic Neurotransmission in Rat Cerebellum. J Neurochem.
1999, 73, 712-718.
[71] Wang, M.; Chen, J.T.; Ruan, D.Y.; Xu, Y.Z. The influence of developmental period of aluminum exposure on synaptic plasticity in the adult rat dentate gyrus in vivo. Neuroscience. 2002, 113(2), 411-419.
[72] Gonda, Z.; Lehotzky, K.; Miklosi, A. Neurotoxicity induced by prenatal
aluminum exposure in rats. Neurotoxicology. 1996, 17(2), 459-469.
[73] Yokel, R.A.; Hicks, C.L.; Florence, R.L. Aluminum bioavailability from
basic sodium aluminum phosphate, an approved food additive emulsifying
agent, incorporated in cheese. Food Chem Toxicol. 2008, 46(6), 2261-2266.
[74] Yokel, R.A.; McNamara, P.J. Aluminium toxicokinetics: an updated
minireview. Pharmacol Toxicol. 2001, 88(4), 159-167.
[75] GlaxoSmithKline. Boostrix product monograph, Combined diphtheria,
tetanus, acellular pertussis (adsorbed) vaccine for boosternvaccination. Date of Approval: October 21, 2009. http://www.gsk.ca/english/docspdf/
Boostrix_PM_20091021_EN.pdf (Accessed August 11, 2010).
[76] Makidon, P.E.; Bielinska, A.U.; Nigavekar, S.S.; Janczak, K.W.; Knowlton,
J.; Scott, A.J.; Mank, N.; Cao, Z.; Rathinavelu, S.; Beer, M.R.; Wilkinson,
J.E.; Blanco, L.P.; Landers, J.J.; Baker, J.R., Jr. Pre-clinical evaluation of a
novel nanoemulsion-based hepatitis B mucosal vaccine. PLoS One. 2008,
3(8), e2954.
[77] Redhead, K.; Quinlan, G.J.; Das, R.G.; Gutteridge, J.M. Aluminiumadjuvanted vaccines transiently increase aluminium levels in murine brain tissue. Pharmacol Toxicol. 1992, 70(4), 278-280.
[78] Levy, R.; Shohat, L.; Solomon, B. Specificity of an anti-aluminium
monoclonal antibody toward free and protein-bound aluminium. J Inorg
Biochem. 1998, 69(3), 159-163.[79] Flarend, R.E.; Hem, S.L.; White, J.L.; Elmore, D.; Suckow, M.A.; Rudy,
A.C.; Dandashli, E.A. In vivo absorption of aluminium-containing vaccine
adjuvants using 26Al. Vaccine. 1997, 15(12-13), 1314-1318.
[80] Yumoto, S.; Nagai, H.; Matsuzaki, H.; Kobayashi, T.; Tada, W.; Ohki, Y.;
Kakimi, S.; Kobayashi, K. Transplacental passage of 26Al from pregnant rats
to fetuses and 26Al transfer through maternal milk to suckling rats Nucl
Instrum Methods Phys Res B. 2000, 172(1-4), 925-929.
[81] Wyeth Canada. Meningitec product monograph. Date of last approval 2007, pp. 1-29. http://www.wyeth.ca/en/products/Product%20Monographs%
20PDFs/Meningitec_PM.pdf (Accessed September 2, 2010).
[82] Centers for Disease Control and Prevention (CDC). Recommended Adult Immunization Schedule – United States, 2010.
http://www.cdc.gov/mmwr/PDF/wk/mm5901-Immunization.pdf (Accessed
September 15, 2010).
[83] Authier, F.J.; Cherin, P.; Creange, A.; Bonnotte, B.; Ferrer, X.;
Abdelmoumni, A.; Ranoux, D.; Pelletier, J.; Figarella-Branger, D.; Granel,
B.; Maisonobe, T.; Coquet, M.; Degos, J.D.; Gherardi, R.K. Central nervous
system disease in patients with macrophagic myofasciitis. Brain. 2001,
124(Pt 5), 974-983.
[84] Gherardi, R.K.; Coquet, M.; Cherin, P.; Authier, F.J.; Laforet, P.; Belec, L.;
Figarella-Branger, D.; Mussini, J.M.; Pellissier, J.F.; Fardeau, M.
Macrophagic myofasciitis: an emerging entity. Groupe d’Etudes et Recherche sur les Maladies Musculaires Acquises et Dysimmunitaires (GERMMAD) de l’Association Francaise contre les Myopathies (AFM). Lancet. 1998, 352(9125), 347-352.
[85] Gherardi, R.K.; Coquet, M.; Cherin, P.; Belec, L.; Moretto, P.; Dreyfus,
P.A.; Pellissier, J.F.; Chariot, P.; Authier, F.J. Macrophagic myofasciitis
lesions assess long-term persistence of vaccine-derived aluminium hydroxide in muscle. Brain. 2001, 124(Pt 9), 1821-1831.
[86] Authier, F.J.; Sauvat, S.; Christov, C.; Chariot, P.; Raisbeck, G.; Poron,
M.F.; Yiou, F.; Gherardi, R. AlOH3-adjuvanted vaccine-induced
macrophagic myofasciitis in rats is influenced by the genetic background.
Neuromuscul Disord. 2006, 16(5), 347-352.
[87] Holt, P.G.; Upham, J.W.; Sly, P.D. Contemporaneous maturation of
immunologic and respiratory functions during early childhood: implications for development of asthma prevention strategies. J Allergy Clin Immunol. 2005, 116,(1), 16-24.
[88] Romagnani, S. Biology of human TH1 and TH2 cells. J Clin Immunol. 1995, 15(3), 121-129.
[89] Elenkov, I.J.; Chrousos, G.P. Stress Hormones, Th1/Th2 patterns, Pro/Antiinflammatory Cytokines and Susceptibility to Disease. Trends Endocrinol Metab. 1999, 10(9), 359-368.
[90] Wrensch, M.; Weinberg, A.; Wiencke, J.; Miike, R.; Sison, J.; Wiemels, J.;
Barger, G.; DeLorenze, G.; Aldape, K.; Kelsey, K. History of chickenpox
and shingles and prevalence of antibodies to varicella-zoster viru s and three other herpesviruses among adults with glioma and controls. Am J Epidemiol. 2005, 161, 929-938.
[91] Silverberg, J.I.; Norowitz, K.B.; Kleiman, E.; Durkin, H.G.; Smith-Norowitz, T.A. Varicella zoster virus (wild-type) infection, but not varicella vaccine, in late childhood is associated with delayed asthma onset, milder symptoms, and decreased atopy. Pediatr Asthma Allergy Immunol.2009, 22, 15-20.
[92] Silverberg, J.I.; Norowitz, K.B.; Kleiman, E.; Silverberg, N.B.; Durkin,
H.G.; Joks, R.; Smith-Norowitz, T.A. Association between varicella zoster
virus infection and atopic dermatitis in early and late childhood: a case control study. J Allergy Clin Immunol. 2010, 126, 300-305.
[93] Sasco, A.J.; Paffenbarger, R.S., Jr. Measles infection and Parkinson’s
disease. Am J Epidemiol. 1985, 122(6), 1017-1031.
[94] GlaxoSmithKline. Engerix-B product monograph. 2010, pp. 1-14.
http://us.gsk.com/products/assets/us_engerixb.pdf (Accessed September 20,
2010).
[95] Schurmans, S.; Heusser, C.H.; Qin, H.Y.; Merino, J.; Brighouse, G.;
Lambert, P.H. In vivo effects of anti-IL-4 monoclonal antibody on neonatal
induction of tolerance and on an associated autoimmune syndrome. J
Immunol. 1990, 145, 2465-2473.[96] Fournie, G.J.; Mas, M.; Cautain, B.; Savignac, M.; Subra, J.F.; Pelletier, L.;
Saoudi, A.; Lagrange, D.; Calise, M.; Druet, P. Induction of autoimmunity
through bystander effects. Lessons from immunological disorders induced by heavy metals. J Autoimmun. 2001, 16, 319-326.
[97] EMEA. Hexavac, scientific discussion. 2004, pp. 1-33.
http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-
_Scientific_Discussion/human/000298/WC500074582.pdf (Accessed
October 12, 2010).
[98] Zinka, B.; Rauch, E.; Buettner, A.; Rueff, F.; Penning, R. Unexplained cases of sudden infant death shortly after hexavalent vaccination. Vaccine. 2006, 24(31-32), 5779-5780.
[99] Banks, W.A.; Kastin, A.J. Aluminum-induced neurotoxicity: alterations in membrane function at the blood-brain barrier. Neurosci Biobehav Rev. 1989, 13(1), 47-53.
[100] Li, X.; Zheng, H.; Zhang, Z.; Li, M.; Huang, Z.; Schluesener, H.J.; Li, Y.;
Xu, S. Glia activation induced by peripheral administration of aluminum
oxide nanoparticles in rat brains. Nanomed Nanotech Biol Med. 2009, 5(4),
473-479.
[101] Campbell, A. Inflammation, neurodegenerative diseases, and environmental exposures. Ann N Y Acad Sci. 2004, 1035, 117-132.
[102] Garrel, C.; Lafond, J.L.; Guiraud, P.; Faure, P.; Favier, A. Induction of
production of nitric oxide in microglial cells by insoluble form of aluminium. Ann N Y Acad Sci. 1994, 738, 455-461.
[103] Struys-Ponsar, C.; Guillard, O.; van den Bosch de Aguilar, P. Effects of
aluminum exposure on glutamate metabolism: a possible explanation for its toxicity. Exp Neurol. 2000, 163(1), 157-164.
[104] Tsunoda, M.; Sharma, R.P. Modulation of tumor necrosis factor alpha
expression in mouse brain after exposure to aluminum in drinking water.
Arch Toxicol. 1999, 73(8-9), 419-426.
[105] Block, M.L.; Hong, J.S. Microglia and inflammation-mediated
neurodegeneration: multiple triggers with a common mechanism. Prog
Neurobiol. 2005, 76(2), 77-98.
[106] Lukiw, W.J.; Bazan, N.G. Neuroinflammatory signaling upregulation in Alzheimer’s disease. Neurochem Res. 2000, 25(9-10), 1173-1184.
[107] Campbell, A.; Becaria, A.; Lahiri, D.K.; Sharman, K.; Bondy, S.C. Chronic exposure to aluminum in drinking water increases inflammatory parameters selectively in the brain. J Neurosci Res. 2004, 75(4), 565-572.
[108] Cohly, H.H.; Panja, A. Immunological findings in autism. Int Rev Neurobiol. 2005, 71, 317-341.
[109] Vargas, D.L.; Nascimbene, C.; Krishnan, C.; Zimmerman, A.W.; Pardo, C.A. Neuroglial activation and neuroinflammation in the brain of patients with autism. Ann Neurol. 2005, 57(1), 67-81.
[110] Pardo, C.A.; Vargas, D.L.; Zimmerman, A.W. Immunity, neuroglia and
neuroinflammation in autism. Int Rev Psychiatry. 2005, 17(6), 485-495.
[111] Shirabe, T.; Irie, K.; Uchida, M. Autopsy case of aluminum encephalopathy. Neuropathology. 2002, 22(3), 206-210.
[112] Platt, B.; Fiddler, G.; Riedel, G.; Henderson, Z. Aluminium toxicity in the rat brain: histochemical and immunocytochemical evidence. Brain Res Bull. 2001, 55(2), 257-267.
[113] Alexandrov, P.N.; Zhao, Y.; Pogue, A.I.; Tarr, M.A.; Kruck, T.P.; Percy,
M.E.; Cui, J.G.; Lukiw, W.J. Synergistic effects of iron and aluminum on
stress-related gene expression in primary human neural cells. J Alzheimers
Dis. 2005, 8(2), 117-127; discussion 209-115.
[114] Lukiw, W.J.; Percy, M.E.; Kruck, T.P. Nanomolar aluminum induces proinflammatory and pro-apoptotic gene expression in human brain cells in primary culture. J Inorg Biochem. 2005, 99(9), 1895-1898.
[115] Pogue, A.I.; Li, Y.Y.; Cui, J.G.; Zhao, Y.; Kruck, T.P.; Percy, M.E.; Tarr,
M.A.; Lukiw, W.J. Characterization of an NF-kappaB-regulated, miRNA-
146a-mediated down-regulation of complement factor H (CFH) in metalsulfate- stressed human brain cells. J Inorg Biochem. 2009, 103(11), 1591- 1595.
[116] Lukiw, W.J. In Aluminium and Alzheimer’s Disease: The science that
describes the link. Exley, C., Ed.; Elsevier Science: Amsterdam. 2001, pp.
147-169.