Tipos de Inyecciones contra C0V¡D y Eficiencia real Parte 1
Dra. Karina Acevedo Whitehouse
https://www.bitchute.com/video/Swz7AwPY2ynX/
Introducción
La variedad de medios utilizados para producir vacunas hoy en día es inmensa, empleando procedimientos tanto lícitos como cuestionables. Para ayudar a comprender estos modos de producción, ofrecemos este manual sobre la ciencia básica involucrada.
La célula humana
Desde el día 1 de la fertilización del óvulo y el posterior desarrollo del embrión, cada ser humano consta de un código genético (o genoma) único que consiste en ácido desoxirribonucleico (o ADN). Esta información genética está estrechamente empaquetada y organizada en cromosomas (numerados 1-22, más 2 cromosomas sexuales X y / o Y) y se almacena en el núcleo de cada célula humana.
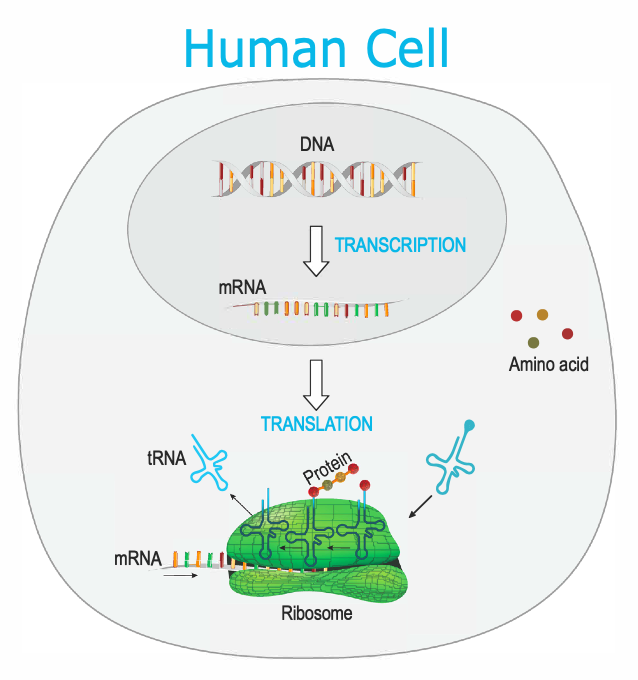
El ADN consta de cuatro nucleótidos diferentes (A, G, C, T) que se unen en una sola hebra y forman una secuencia. El ADN se encuentra normalmente como una molécula de doble hebra, en la que dos hebras de ADN separadas se enrollan entre sí para formar una doble hélice y cada nucleótido de una hebra forma un par de bases con el nucleótido de la hebra opuesta.
De la misma manera que 26 letras del alfabeto se combinan para crear un sinnúmero de palabras y oraciones para comunicarse, así ocurre con el ADN. Los cuatro nucleótidos se combinan de diferentes formas para crear varias secuencias, llamadas genes, que son unidades fundamentales de información genética que proporcionan instrucciones específicas para una propiedad o función particular dentro de la célula.
El ADN es la copia original de la información genética, pero el ADN no se utiliza como fuente directa de instrucciones en la célula. En cambio, el ADN envía información genética a toda la célula en forma de ácido ribonucleico mensajero ( ARNm ). El ARNm es una secuencia de ácido nucleico que es complementaria a la hebra de ADN molde, pero químicamente ligeramente diferente. El proceso por el cual el ADN transfiere información al ARNm se llama transcripción. Como tal, los genes pueden activarse y desactivarse, y los mensajes pueden enviarse y entregarse por toda la célula con precisión exacta.
Una vez que se genera el ARNm, la información que lleva debe convertirse de un idioma a otro. El “lenguaje” del ARNm que utiliza ácidos nucleicos, o código genético, se traduce a un “lenguaje” de proteínas utilizando aminoácidos. Este mecanismo de producción de proteínas utilizando la información proporcionada por el ARNm se llama traducción. Por cada tres bases de nucleótidos de ARNm (llamado codón) que se traducen, se coloca un aminoácido en la secuencia de la proteína. La secuencia de ARNm traducida codificará una proteína que consta de varios aminoácidos unidos como perlas en un collar. El producto proteico final creado se pliega en una estructura tridimensional y lleva a cabo su función y propósito específicos dentro de la célula.
Infección viral de la célula humana
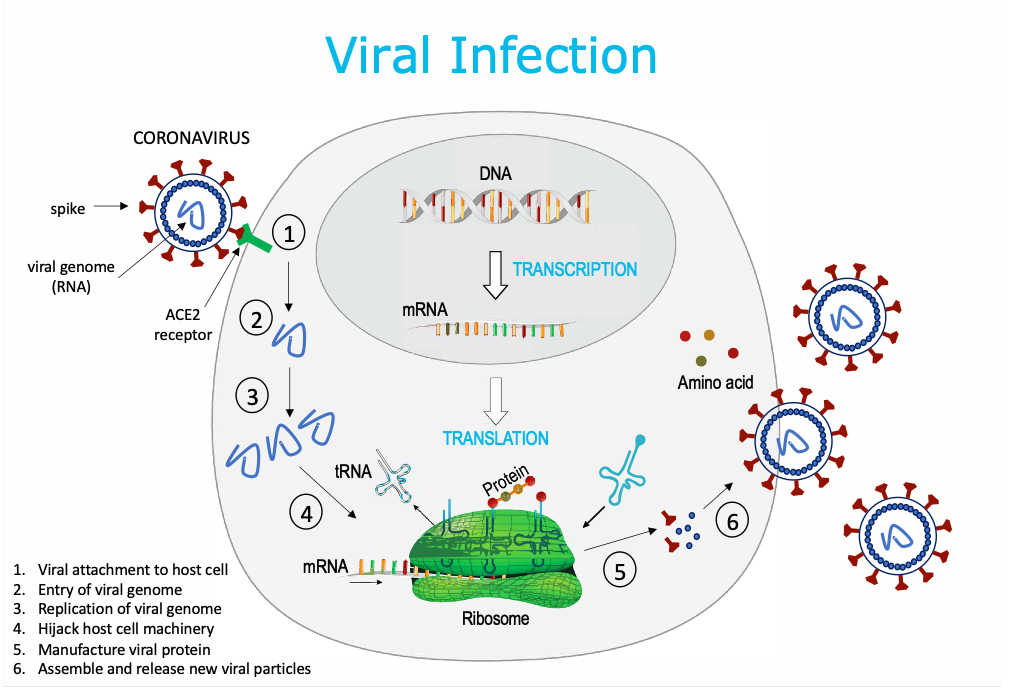
Un virus infecta al huésped y secuestra la maquinaria celular como un parásito para replicarse (producir más partículas de virus) e infectar más células huésped. El genoma viral (ADN o ARN) ingresa a una célula humana, replica más secuencias de ADN y / o ARN y luego utiliza la maquinaria de la célula para fabricar proteína viral, de modo que se puedan ensamblar y liberar más partículas virales en el huésped.
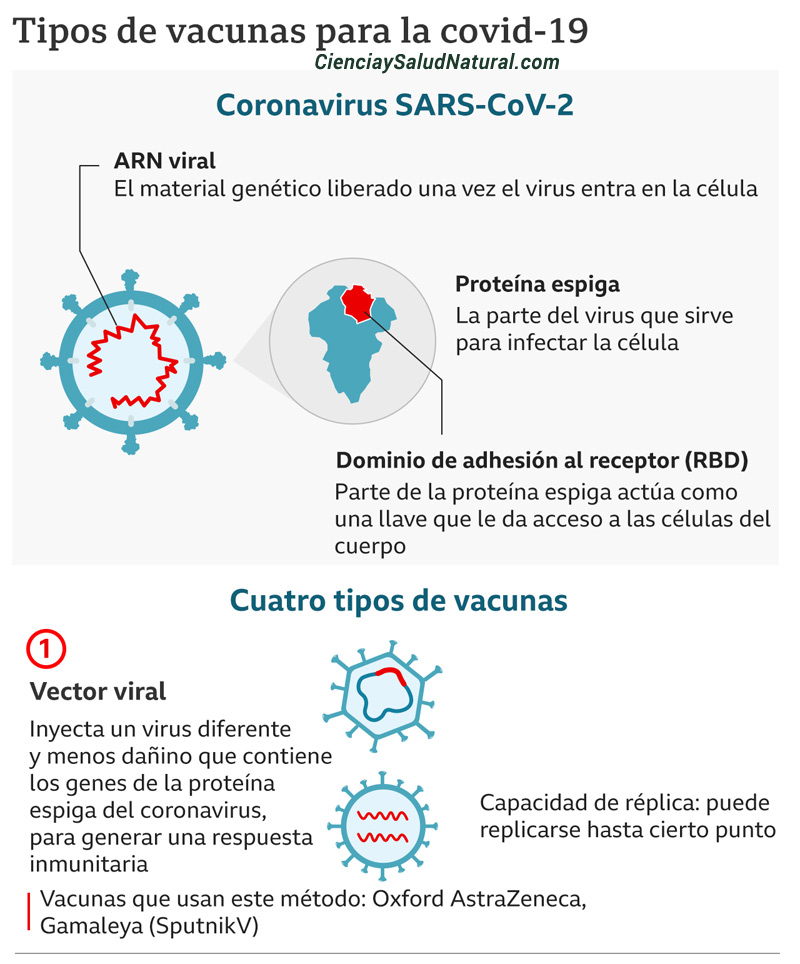
Los coronavirus (CoV) son una gran familia de virus de ARN monocatenario (de aproximadamente 30 kilobases de longitud) con apariencia de corona debido a la presencia de glicoproteínas de superficie de picos en la envoltura que rodea el genoma viral. Estos virus pueden atravesar las barreras de las especies y causar, en los seres humanos, enfermedades que van desde el resfriado común hasta enfermedades respiratorias más graves, como el síndrome respiratorio de Oriente Medio (MERS-CoV) y el síndrome respiratorio agudo severo (SARS-CoV). Un nuevo virus SARS-CoV-2 que pertenece a la familia de los coronavirus causa una nueva enfermedad identificada por primera vez en Wuhan, CHINA a fines de 2019, llamada COVID-19.
El primer paso de la infección viral por SARS-CoV-2 implica la unión de la proteína de pico del coronavirus al receptor de entrada de la enzima convertidora de angiotensina 2 (ACE2) en la célula huésped. Una vez dentro de la célula huésped, la secuencia de ARNm del genoma del SARS-CoV-2 codificará varias proteínas, incluida la glicoproteína de la superficie de la espiga. Mediante este mecanismo, el virus puede producir partículas más virulentas para infectar otras células huésped.
Desarrollo de vacunas virales
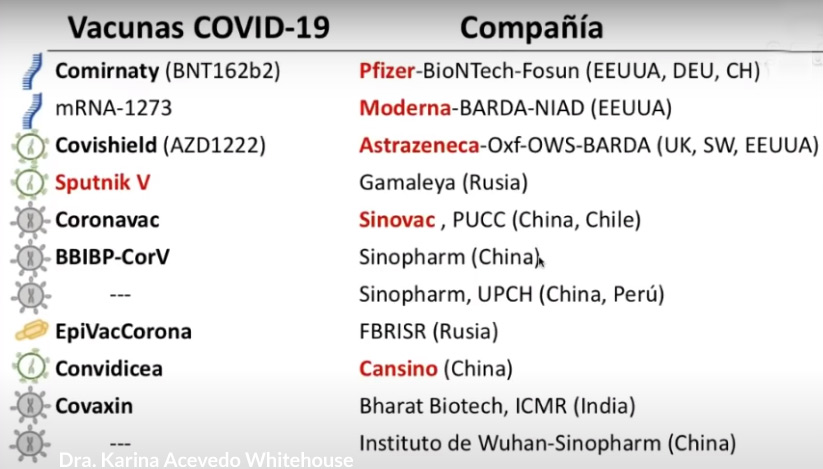
Se están utilizando cinco estrategias principales para desarrollar una vacuna contra una amenaza de enfermedad recientemente reconocida, el coronavirus SARS-CoV-2 que causa COVID-19. Varias empresas de biotecnología, organizaciones académicas y empresas farmacéuticas están empleando estas diferentes tecnologías en la carrera por llevar su vacuna candidata a ensayos clínicos.
La Organización Mundial de la Salud (OMS) espera que una vacuna esté disponible para octubre de 2021. Una vez desarrolladas con seguridad y eficacia probadas, las vacunas se inyectan en humanos para provocar una respuesta inmunitaria que incluye la formación de anticuerpos y de células de memoria inmunitaria.
Cuando una persona está infectada con el patógeno real, la respuesta inmune recordará el objetivo y atacará para prevenir la infección de la célula huésped. A continuación se describe una breve descripción y una ilustración sencilla de cada estrategia.
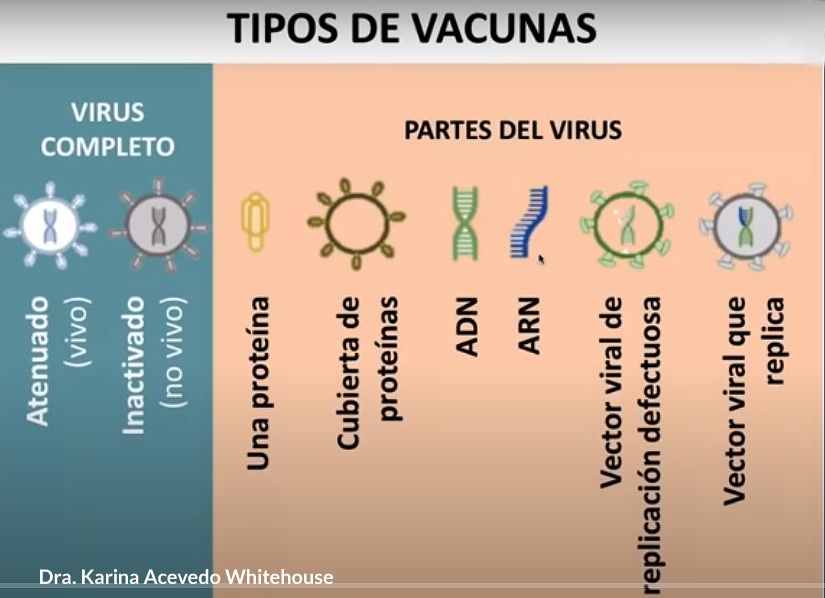
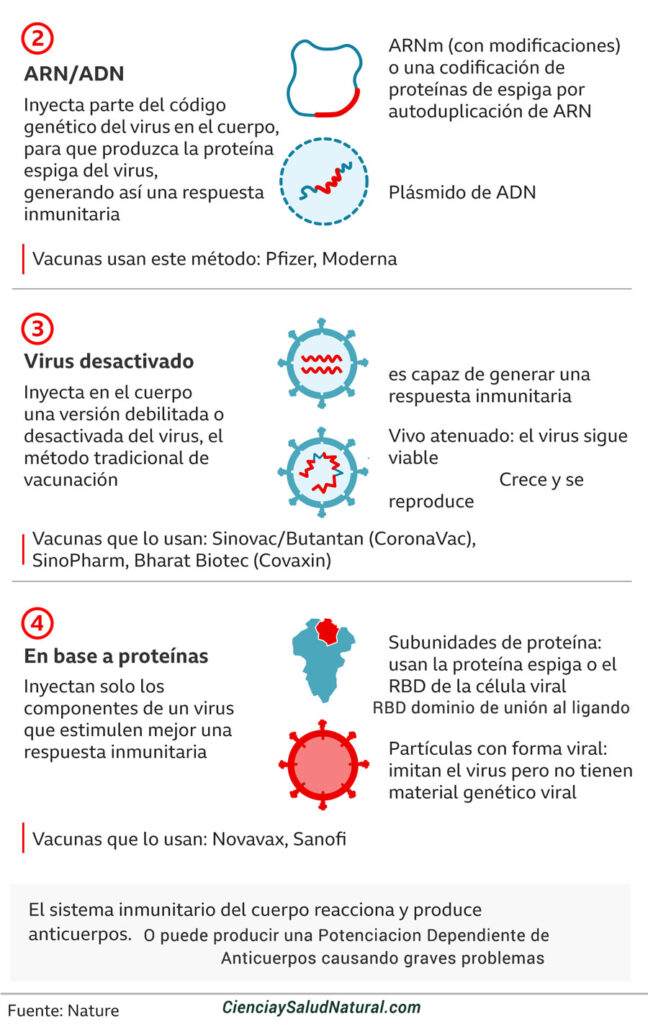
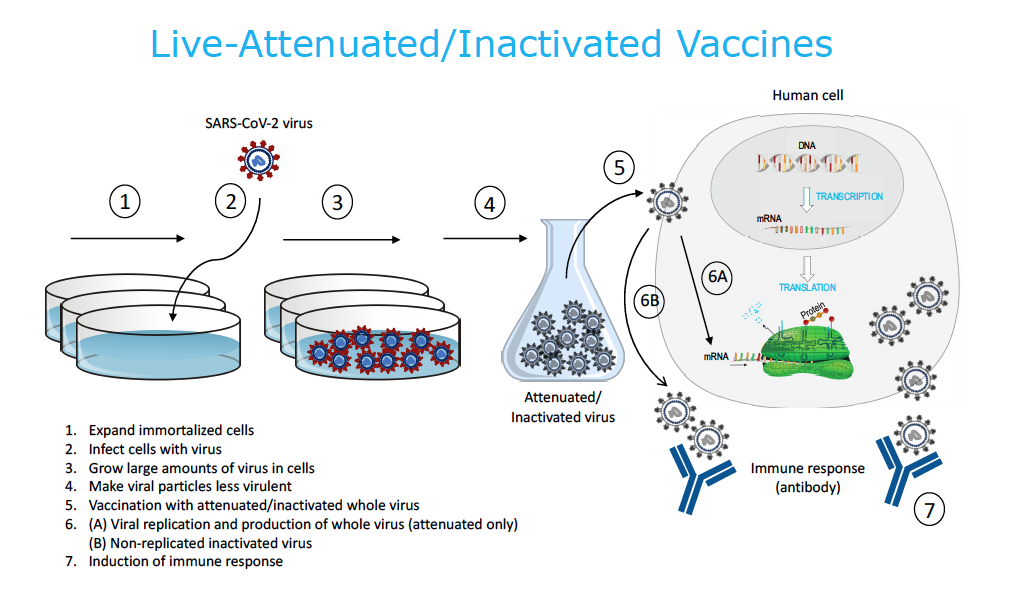
1. Vacunas vivas atenuadas / inactivadas
Como parte del proceso de fabricación, este tipo de vacuna se produce cultivando grandes cantidades del virión completo en un entorno de laboratorio controlado. Todo el virus del SARS-CoV-2 se “mata” (inactiva), “atenúa” (debilita) o se sintetiza una versión recodificada del virus que es menos virulenta. Esta técnica requiere que las células produzcan grandes cantidades de la vacuna viral. Se utilizan líneas de células humanas cultivadas de fetos abortados (por ejemplo, PER.c6, HEK293) o alternativas éticas (por ejemplo, K562, sangre de cordón, placenta). También se encuentran disponibles líneas de células animales (por ejemplo, células de mono Vero, células de hámster CHO, células de insecto Sf9, etc.). Los huevos de gallina embrionados también se utilizan para algunas vacunas. Una vez que se inyecta la vacuna, la vacuna viral atenuada o inactivada se replica dentro de la célula, se libera en el cuerpo y el sistema inmunológico lo reconoce como extraño, y se genera una respuesta inmunitaria. Las vacunas vivas atenuadas / inactivadas son infecciosas. Existen vacunas humanas autorizadas que utilizan esta misma plataforma.
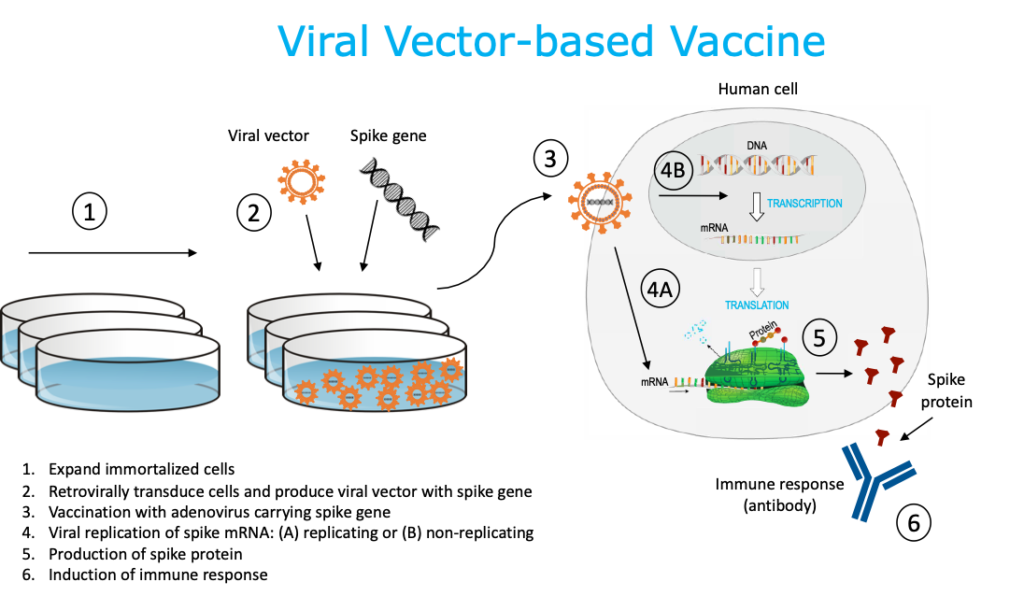
2. Vacuna basada en vectores virales
Esta técnica utiliza un sistema de vector de virus modificado genéticamente (p. Ej., Adenovirus, sarampión, VSV) que llevará un gen que codifica una diana viral del SARS-CoV-2, a menudo la proteína de pico superficial (S). Las líneas de células humanas cultivadas (por ejemplo, PER.c6, HEK293) se utilizan como “fábricas” para producir grandes cantidades de virus manipulados. Alternativamente, también se pueden usar líneas de células animales (p. Ej., Células de mono Vero, células de hámster CHO, células de insecto Sf9, etc.) Una vez inyectada, la vacuna basada en el vector viral ingresa a la célula huésped y el ADN viral modificado se transcribe en ARNm usando maquinaria del vector viral (replicante) o maquinaria de la célula huésped (replicación deficiente). A continuación, la maquinaria de la célula huésped traduce el ARNm en la proteína espiga del SARS-CoV-2, que se libera de la célula. La inmunidad del vector preexistente podría afectar negativamente a la eficacia de la vacuna dependiendo del vector elegido (por ejemplo, de una infección previa por adenovirus). Las vacunas basadas en vectores virales no son infecciosas. Existe una vacuna humana con licencia que utiliza esta misma plataforma.
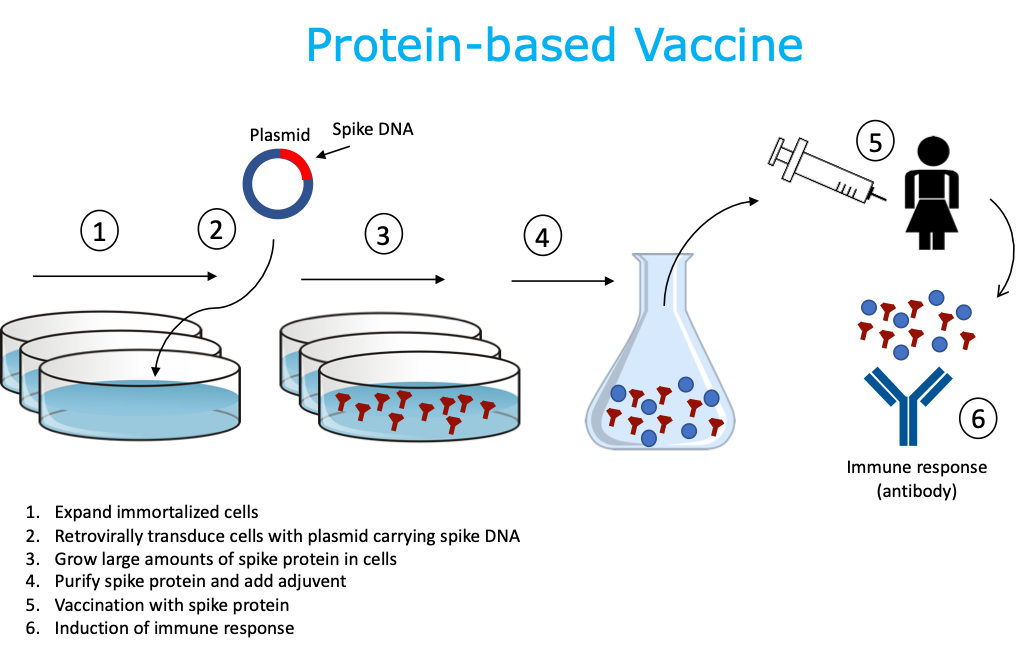
3. Vacuna a base de proteínas
La vacuna consta solo de proteína, como la proteína de pico viral, que se sintetiza y produce mediante técnicas de genética recombinante en el laboratorio, donde una parte de la proteína (o subunidad) se produce sola, sin necesidad del patógeno de crecimiento infeccioso completo. . Para producir una proteína recombinante o “sintética”, el ADN que codifica una región del virus (p. Ej., Espiga) se combina con un plásmido que ayudará a transportar las instrucciones del ADN para producir la proteína viral. Se utiliza una línea de células huésped para producir rápidamente la proteína. Esta proteína se cultiva a granel, se recolecta, se purifica, se combina con adyuvante para mejorar la respuesta inmune y luego se empaqueta como vacuna recombinante. Las líneas celulares de cultivo humano o animal se utilizan comúnmente para producir la proteína, así como huevos de gallina fertilizados. Las vacunas a base de proteínas no son infecciosas. Hay existentes,
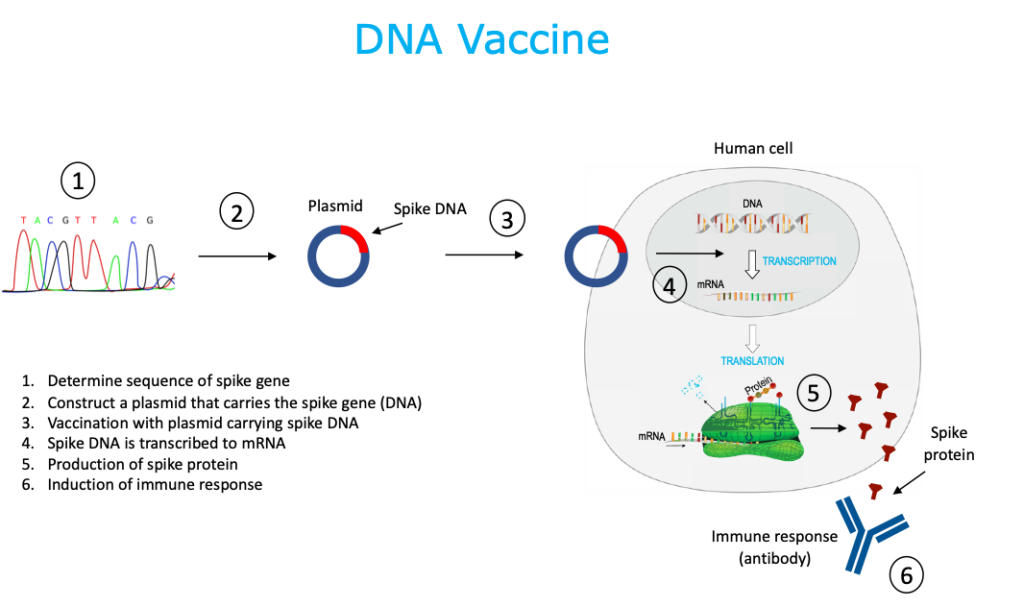
4. Vacuna de ADN
Se sintetiza un plásmido que porta el gen de la espiga que codificará la proteína espiga del SARS-CoV-2. El ADN se sintetiza química o enzimáticamente en el laboratorio, sin el uso de células. El plásmido ingresa al núcleo de la célula huésped. El ADN se transcribe en ARNm, el ARNm se traduce para producir la proteína de superficie del SARS-CoV-2 y se libera la proteína de superficie del SARS-CoV-2. Las vacunas de ADN no son infecciosas. Esta tecnología es nueva y actualmente no existen vacunas humanas autorizadas que utilicen esta plataforma.
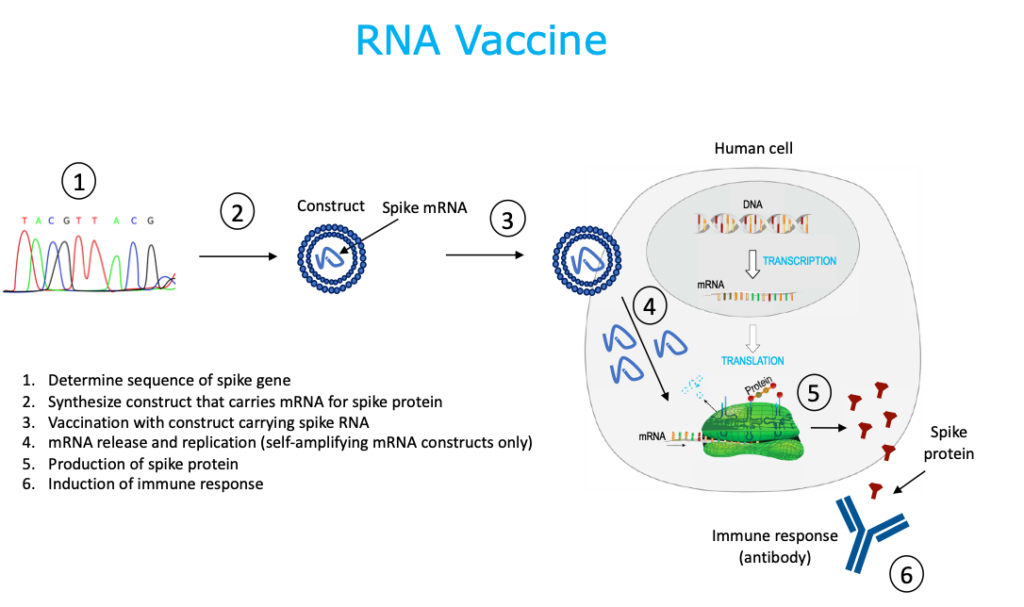
5. Vacuna de ARN
Las vacunas de ARN utilizan ARNm que lleva el código de la proteína de pico SARS-CoV-2. Estas vacunas pueden ser una construcción de ARNm no replicante o una construcción de ARNm autoamplificadora, capaces de dirigir la amplificación de ARNm intracelular. El ARNm se sintetiza química o enzimáticamente en el laboratorio, sin el uso de células. Las nanopartículas de lípidos encapsulan las construcciones de ARNm para protegerlas de la degradación y promover la absorción celular. Este es un sistema sin células. Las vacunas de ARNm no son infecciosas. Esta tecnología es nueva y actualmente no existen vacunas humanas autorizadas que utilicen esta plataforma, pero los estudios muestran que pueden provocar inmunidad contra la gripe, el Zika, la rabia y el coronavirus.
Candidatos a vacuna e inyecciones contra COVID-19 y líneas celulares derivadas de abortos
La información precisa sobre el desarrollo y la producción de las vacunas COVID-19 es esencial, especialmente porque muchos candidatos propuestos utilizan tecnologías moleculares más nuevas para la producción de una vacuna viral. Una preocupación con respecto a la evaluación ética de los candidatos a vacunas virales es el uso potencial de líneas celulares derivadas de abortos en el desarrollo, producción o prueba de una vacuna. Este análisis utiliza datos de la literatura científica primaria cuando está disponible, junto con datos de documentos de ensayos clínicos e información comercial publicada. 1
Diagrama de flujo para la creación y prueba de vacunas
PseudovirusHEK293 cellsWard et al., medRxiv 6Nov2020
| Análisis de candidatos a vacuna contra el SARS-CoV-2 (COVID-19)Última actualización 4 de enero de 2020 | 🟩 NO UTILIZA línea celular derivada del aborto 🔺 UTILIZA línea celular derivada del aborto 🟩🔺 ALGUNAS pruebas NO usan células derivadas del aborto, ALGUNAS SI. Actualmente indeterminado | ||||||
| Patrocinador (es) 1 | País | Estrategia 2 | Estado del ensayo clínico 3 | Financiamiento público 4 | Desarrollo de diseño | Producción | Pruebas de laboratorio de confirmación |
| VACUNA CONTRA VIRUS – VIVA ATENUADA O INACTIVADA | |||||||
| Instituto de Productos Biológicos de Beijing / Sinopharm | China | Virus inactivado”BBIBP-CorV”Dado: intramuscular2 dosis (con 2 semanas de diferencia) | Aprobación anticipada en ChinaFase 3Fase 3 | 🟩Células de mono Vero | 🟩Células de mono Vero | 🟩Prueba citopática | |
| Instituto de Productos Biológicos de Wuhan / Sinopharm | China | Virus inactivadoSin nombreDado: intramuscular2 dosis (con 2 semanas de diferencia) | Fase 3Aprobación anticipada en ChinaFase 1/2 | 🟩Vero monkey cells Xia et al., JAMA 324, 951, 13Aug2020 | 🟩Células de mono VeroXia et al., JAMA 324, 951, 13Aug2020 | 🟩 Prueba de neutralización con reducción de placa Células de mono Vero Xia et al., JAMA 324, 951, 13Aug2020 | |
| Bharat Biotech / Consejo Indio de Investigación Médica | India | Virus inactivado “BBV152” Administrado : Dosis intramusculares2 (con 2 semanas de diferencia) | India EE. UU. ConcedidaFase 3Fase 1/2Fase 1/2Fase 1/2 | 🟩Células de mono VeroYadav et al., ResearchSquare 10Sept2020 | 🟩Células de mono VeroYadav et al., ResearchSquare 10Sept2020 | 🟩 Anticuerpo ELISA Reducción de placa Células de mono Vero Yadav et al., ResearchSquare 10Sept2020 | |
| Instituto de Investigaciones Médicas Juan Pablo II | USA | Virus vivo atenuado | Preclínico | 🟩Las líneas celulares éticas como cuestión de política | 🟩Células humanas perinatales (cordón umbilical y placentario a término) | � | |
| Sinovac Biotech Co., Ltd. | China | Virus inactivado”PiCoVacc”Dado: intramuscular2 dosis (con 2 semanas de diferencia) | Fase 3Aprobación anticipada en ChinaFase 3Fase 1/2Fase 1/2Fase 1/2 | 🟩Células de mono Vero | 🟩Células de mono VeroGao et al ., Science 369, 77, 3 de julio de 2020 | 🟩🔺prueba de proteínaCélulas HEK293Suplemento Gao et al., Science 369, 77, 3 de julio de 2020 | |
| Valneva y Dynavax | Francia Estados Unidos Reino Unido | Virus inactivado “VLA2001” más adyuvante CpG1018 administrado : intramuscular | Preclínico | 🟩Células de mono Vero | 🟩Células de mono VeroMisma plataforma que IXIARO, nota de prensa de Valneva, 22 de abril de 2020 | � | |
| VACUNA VIRAL VECTORIAL | |||||||
| Altinmune | USA | Replicación deficienteVector de adenovirus”AdCOVID”Dado: Intranasal | Preclínico | 🔺Células PER.C6 | 🔺Células PER.C6Misma plataforma que NasoVAXNasoVAX utiliza PER.C6PER.C6 con licencia de Janssen | 🔺 | |
| AstraZenecaUniversidad de Oxford | USAReino Unido | Replicación deficienteVector de adenovirus”AZD1222″”ChAdOX1nCoV-19″Dado: intramuscular2 dosis (4 semanas de diferencia) | Reino Unido EUA concedido India EUA concedido Fase 3 Fase 3 Fase 3 Fase 2/3 Fase 2/3 Fase 1/2 Fase 1/2 | Operación Warp SpeedHHS-BARDA$ 1.2 mil millonesCEPI hasta $ 384 millones | 🔺Células HEK293 | 🔺Células HEK293van Doremalen et al ., Nature preprint, 30 de julio de 2020 | 🔺 |
| CanSino Biologics, Inc.Instituto de Biotecnología de Beijing, Academia de Ciencias Médicas Militares, PLA de China | China | Replicación deficienteVector de adenovirus”Ad5-nCoV”Dado: intramuscular1 dosis | Fase 3Fase 3Fase 2Fase 2Fase 2Fase 1Fase 1 | 🔺Células HEK293 | 🔺Células HEK293Biospace, 12 de mayo de 2020 | 🔺 | |
| Instituto de Investigaciones Gamaleya | Rusia | Replicación deficienteVectores de adenovirus(rAd26-S + rAd5-S)”Sputnik V”Dado: intramuscular2 dosis (con 3 semanas de diferencia) | Fase 3Aprobación anticipada en Rusia agosto de 2020Fase 1/2Fase 1/2 | 🔺Células HEK293 | 🔺Células HEK293 | 🔺 | |
| ImmunityBio y NantKwest | USA | Vector de adenovirus de replicación deficiente recombinante “hAd5 S-Fusion + N-ETSD” Dado: subcutáneo | Fase 1 | 🔺 Células E.C7 (derivado de células HEK293) Rice et al., BioRxiv 30Julio2020 | 🔺Células E.C7 (derivado de células HEK293) Rice et al., BioRxiv 30 de julio de 2020 | 🔺 Pruebas de proteínas y anticuerpos Células HEK293T Rice et al., BioRxiv 30July2020 Seiling et al., MedRxiv 6Nov2020 | |
| Institut Pasteur y Themis y Merck | USAFrancia | Virus del sarampión recombinante con capacidad de replicación”TMV-083″Dado: intramuscular | Fase 1/2Fase 1 | CEPI hasta $ 4.9 millones | 🔺 HEK293TDesarrollo y rescate del virus del sarampión recombinanteHörner et al., PNAS 22 de diciembre de 2020Horner et al . Supplement“Los candidatos a vacuna que codifican el SARS-CoV-2 S … se generaron como se describió anteriormente “ | 🟩Células de mono VeroHörner et al., PNAS 22 de diciembre de 2020Horner et al . Supplement | 🟩🔺 Vectores lentivirales para DCF antigénico Prueba fusogénica HEK293T Prueba fusogénica Expresión de proteínas Células de mono Vero Hörner et al., PNAS 22Dec2020 Hörner et al . Suplemento |
| Instituto de Investigaciones Biológicas de Israel (IIBR) | Israel | Virus de la estomatitis vesicular recombinante competente en replicación (VSVΔG) “IIBR-100” Administrado : dosis intramuscular1 | Fase 1 | 🟩 Células de hámster BHK Células de mono Vero Yahalom-Ronen et al., BioRxiv 19June2020 | 🟩 Células de mono Vero Yahalom-Ronen et al., BioRxiv 19 de junio de 2020 | 🟩 Reducción de placa; inmunofluorescencia células de mono Vero Yahalom-Ronen et al., bioRxiv 19 de junio de 2020 | |
| Investigación y desarrollo de Janssen, Inc.Johnson y Johnson | USA | Replicación deficienteVector de adenovirus”Ad26″ dado: intramuscular1 o 2 dosis (con 8 semanas de diferencia) | Fase 3Fase 3Fase 1/2 | Operación Warp SpeedHHS-BARDA$1,457,887,081 total | 🔺Células PER.C6 | 🔺Células PER.C6Tostanoski et al., Nature Medicine, 3Sept2020;J&J, 30 de marzo de 2020 ;Tecnologías de vacunas de Janssen | 🔺 |
| Merck e IAVI | USA | Virus de la estomatitis vesicular recombinante competente en replicación (VSVΔG)”V590″Dado: intramuscular | Preclínico | Operación Warp SpeedHHS-BARDA$38,033,570 | 🟩Células de mono Vero | 🟩Células de mono VeroUtilice la plataforma rVSV ErveboErvebo utiliza el cultivo de células Vero-11 Descripción | � |
| Shenzhen Geno-inmuneInstituto Médico | China | Lentivirus minigenes +APC (células presentadoras de antígeno) humanas adultas | Fase 1 | 🟩 | |||
| Shenzhen Geno-inmuneInstituto Médico | China | Lentivirus minigenes +Células CD / T humanas adultas (células dendríticas y células T)”LV-SMENP-DC” | Fase 1/2 | 🟩 | |||
| Vaxart | USA | Replicación deficienteVector de adenovirus”VXA-CoV2-1″más adyuvante dsRNADado: Oral | Fase 1 | 🔺Células HEK293 | 🔺Células HEK293Moore et al., bioRxiv 6Sept2020 | 🔺 | |
| VACUNA A BASE DE PROTEINAS | |||||||
| Anhui Zhifei Longcom Biofarmacéutico / Instituto de Microbiología, Academia China de Ciencias | China | Vacuna proteicaDímero de RBD recombinantemás adyuvanteDado: intramuscular2 o 3 dosis (con 30 días de diferencia) | Fase 3Fase 2Fase 1/2Fase 1 | 🔺Células HEK293TDai et al., Cell 6Aug2020 | 🟩Células de hámster CHODai et al., Cell 6Aug2020 | 🔺PseudovirusCélulas HEK293TDai et al., Cell 6Aug2020 | |
| Clover Biopharmaceuticals, Inc. | China | Vacuna proteica”SCB-2019″más adyuvante CpG 1018Dado: intramuscular | Fase 1 | CEPI hasta $ 69,5 millones | 🟩cDNA en vector de expresión; transfectar células de hámster CHOLiang y col., BioRxiv , 24Sept2020Sistema Trimer-Tag ;Liu et al., Scientific Reports 2017 | 🟩Células de hámster CHOSistema Trimer-Tag ;Liu et al., Scientific Reports 2017 | 🟩🔺PseudovirusCélulas HEK293Ref .: Nie et al., Microbios e infecciones emergentes 24 de marzo de 2020Efecto citopáticoCélulas de mono VeroLiang y col., BioRxiv , 24Sept2020 |
| Institución Federal de Investigación Presupuestaria Centro Estatal de Investigación de Virología y Biotecnología “Vektor” | Rusia | Vacuna proteica “EpiVacCorona” Antígenos peptídicos del SARS-CoV-2 sintetizados químicamente, conjugados con una proteína transportadora adsorbida en un adyuvante que contiene aluminio . Administrado: Intramuscular2 dosis (con 3 semanas de diferencia) | Aprobación anticipada en Rusia Oct 2020Fase 1Fase 1 | � | 🟩antígenos peptídicos sintetizados químicamente | ||
| Instituto de Investigaciones Médicas Juan Pablo II | USA | Proteína recombinanteCélulas humanas perinatales (cordón umbilical y placentario a término) | Preclínico | 🟩Las líneas celulares éticas como cuestión de política | 🟩Células humanas perinatales (cordón umbilical y placentario a término) | ||
| Kentucky BioProcessing, Inc. (British American Tobacco) | USA | Vacuna proteica “KBP-201” RBD expresada en plantas Administrada : Intramuscular2 dosis (con 3 semanas de diferencia) | Fase 1/2 | 🟩Secuencia de ADN recombinante para RBD de SARS-CoV-2 | 🟩Expresión vegetal del péptido RBD | � | |
| Medicago | Canadá | Proteína en partículas similares a virus”CoVLP”Partícula de proteína de pico expresada en plantas con adyuvante, CpG1018 o AS03Dado: intramuscular2 dosis (con 3 semanas de diferencia) | Fase 2/3Fase 2Fase 1 | 🟩Secuencia de ADN recombinante en Agrobacterium , transformación de células vegetales | 🟩Expresión vegetal de proteínas y VLPWard et al., medRxiv 6Nov2020 | 🟩🔺Células del pseudovirus HEK293Ward et al., medRxiv 6Nov2020 | |
| Novavax | USA | Vacuna proteicaNVX-CoV2373Expresión de baculovirusmás adyuvante Matrix MDado: intramuscular2 dosis (con 3 semanas de diferencia) | Fase 3Fase 3Fase 2Fase 1 | Operación Warp SpeedHHS-BARDA$1,600,434,523CEPI hasta $ 388 millones | 🟩 | 🟩Células de insectos Sf9Bangaru et al. , BioRxiv preprint, 6Aug2020 ;Vista gráfica | 🟩🔺PseudovirusCélulas HEK293Bangaru et al. , BioRxiv preprint, 6Aug2020 |
| Sanofi y GSKCiencias de las Proteínas | USAFrancia | Vacuna proteicaExpresión de baculovirusmás adyuvante AS03Dado: intramuscular2 dosis (con 3 semanas de diferencia) | Fase 1/2 | Operación Warp SpeedHHS-BARDA$2,072,775,336 total | 🟩 | 🟩Células de insectos Sf9Proteína recombinante expresada en baculovirus ; | � |
| Sorrento | USA | Vacuna proteica“T-VIVA-19”Dominio S1 de proteína de pico de SARS-Cov-2 fusionado con IgG-Fc humanaDado: intramuscular | Preclínico | 🟩 | 🟩PARA celdasHerrmann et al., BioRxiv preprint, 30 de junio de 2020 | 🟩ELISA de anticuerpos;Ensayos de neutralizaciónCélulas de mono VeroHerrmann et al., BioRxiv preprint, 30 de junio de 2020 | |
| Sorrento | USA | Vacuna proteica”STI-6991″Proteína de pico de SARS-Cov-2 expresada en células K562 | Preclínico | 🟩Células K562Concepto: Ji et al., Medicine in Drug Discovery March2020 | |||
| Universidad de Pittsburgh | USA | Vacuna proteicaExpresado por adenovirusproteínas recombinantes”PittCoVacc”Dado: matrices de microagujas | Preclínico | 🔺Células HEK293 | 🔺Células HEK293Kim et al., EBioMedicine , 2April2020 | 🔺 | |
| Universidad de Queensland y CSL Ltd. | Australia | Vacuna proteica”V451″Proteína recombinante con abrazadera molecular patentadaDado: intramuscular | DETENIDOFase 1Fase 1Fase 1 | CEPI hasta $ 4.5 millones | 🟩 | 🟩células de hámster expiCHO | � |
| VACUNA DE ARN | |||||||
| Terapéutica de Arcturus | USA | vacuna de ARNmauto-transcribiendo, replicando“LUNAR-CoV19” (“ARCT-021”)reacción de transcripción in vitro con la polimerasa de ARN T7 de la plantilla de plásmido STARRNanopartícula lipídica patentada de LUNAR encapsuladaDado: intramuscular1 dosis | Fase 2Fase 1/2 | 🟩Secuencia diseñada en computadora | 🟩No se utilizan celdasde Alwis et al., bioRxiv 3Sept2020 | 🟩🔺prueba de proteínaHEK293de Alwis et al., bioRxiv 3Sept2020 | |
| CureVac | Alemania | vacuna de ARNmno replicable”CVnCoV”transcripción in vitronanopartícula lipídica encapsuladaDado: intramuscular2 dosis (4 semanas de diferencia) | Fase 2/3Fase 2Fase 1 | CEPI hasta $ 15,3 millones | 🟩Secuencia diseñada en computadora | 🟩No se utilizan celdasRauch et al., bioRxiv 23Oct2020 | 🟩Prueba de proteínasLisado de reticulocitos, células HeLaRauch et al., bioRxiv 23Oct2020 |
| Moderna, Inc.con los Institutos Nacionales de Salud | USA | vacuna de ARNmno replicable”ARNm-1273″Transcripción mediada por ARN polimerasa T7 a partir de plantilla de plásmido de ADNLNP (nanopartícula lipídica) encapsuladaDado: intramuscular2 dosis (4 semanas de diferencia) | Autorización de uso de emergencia aprobada por la FDAFase 3Fase 2Fase 1 | Operación Warp SpeedHHS-BARDA$2,479,894,979 totalCEPI hasta $ 1 millón | 🟩Secuencia diseñada en computadora | 🟩No se utilizan celdasCorbett y col., Nature , 5 de agosto de 2020 | 🟩🔺prueba de proteínay pseudovirusCélulas HEK293Corbett y col., Nature , 5 de agosto de 2020 |
| Pfizer y BioNTech | USAAlemania | vacuna de ARNmno replicable”BNT-162a1, b1, b2, b3, c2″ARNm modificado con nucleósidos in vitro transcrito por la polimerasa T7 a partir de una plantilla de ADN plasmídicoLNP (nanopartícula lipídica) encapsuladaDado: intramuscular2 dosis (con 3 semanas de diferencia) | Autorización de uso de emergencia aprobada por la FDAReino Unido EE.UU. concedidoFase 2/3Fase 1/2Fase 1/2Fase 1Fase 1 | Operación Warp SpeedHHS-BARDA$ 1.95 mil millones | 🟩Secuencia diseñada en computadora | 🟩No se utilizan celdasVogel et al., bioRxiv 8Sept2020 | 🟩🔺prueba de proteínay pseudovirusCélulas HEK293Vogel et al., bioRxiv 8Sept2020 |
| Sanofi Pasteur yTraducir Bio | USAFrancia | vacuna de ARNmno replicable”MRT5500″sintetizado por transcripción in vitro empleando ARN polimerasa con una plantilla de ADN plasmídicoLNP (nanopartícula lipídica) encapsuladaDado: intramuscular | Preclínico | 🟩Secuencia diseñada en computadora | 🟩No se utilizan celdasKalnin et al., bioRxiv 14Oct2020producción de ARNm en el laboratorio ;Traducir plataforma científica Bio | 🟩🔺prueba de proteínay pseudovirusCélulas HEK293Kalnin et al., bioRxiv 14Oct2020 | |
| VACUNA DE ADN | |||||||
| Genexine | Corea | Vacuna de ADN”GX-19″ style = “borde: 1 px negro sólido;”ADN sintetizado in vitro, colocado en vector plásmidoDado: intramuscular y electroporación2 dosis (4 semanas de diferencia) | Fase 1/2 | 🟩Secuencia diseñada en computadora | 🟩No se utilizan celdasSeo et al., bioRxiv 10Oct2020 | � | |
| Inovio Pharmaceuticals | USA | Vacuna de ADN”INO-4800″ADN sintetizado in vitro, colocado en vector plásmidoDado: electroporación intradérmica2 dosis (4 semanas de diferencia) | Fase 2/3Fase 1/2Fase 1 | Operación Warp SpeedCEPI hasta $ 22,5 millones | 🟩Secuencia diseñada en computadora | 🟩No se utilizan celdasSmith et al., Nature 20 de mayo de 2020 | 🟩🔺prueba de proteínay pseudovirusCélulas HEK293Smith et al., Nature 20 de mayo de 2020 |
| Corporación Symvivo | Canadá | Vacuna de ADNBacillus largo modificado genéticamente“BacTRL-spike”Dado: Oral, las bacterias se unen al revestimiento intestinal.1 dosis | Fase 1 | 🟩No se utilizan celdas |
- Datos acumulados de la literatura primaria como se hace referencia en la Tabla; Y “Rastreador de vacunas y tratamientos COVID-19”, Milken Institute, https://covid-19tracker.milkeninstitute.org/ ; Y “Borrador del panorama de las vacunas candidatas al COVID-19”, Organización Mundial de la Salud (OMS), https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines
TENGA EN CUENTA que las patentes no se tienen en cuenta porque son fuentes poco fiables; incluso las patentes más relevantes son documentos prospectivos que brindan ejemplos de uso potencial, pero no brindan información sobre la aplicación actual y real de una invención o tecnología. - Prentice, DA y Sander Lee, T. 15 de junio de 2020. Una ayuda visual para las infecciones virales y la producción de vacunas. On Science Series 1.
- Fases de los ensayos clínicos: estudios preclínicos de laboratorio y en animales; Fase I: 10-100 personas, seguridad del estudio y dosis; Fase II: decenas a cientos de personas, estudio de eficacia, dosis, efectos secundarios; Fase III: cientos a miles de personas, estudio de eficacia y reacciones adversas.
- HHS-BARDA = Autoridad de Desarrollo e Investigación Biomédica Avanzada de Servicios Humanos y de Salud de EE. UU.; CEPI = Coalición de Innovaciones en Preparación para Epidemias; La cartera de contramedidas médicas COVID-19 en rápida expansión de BARDA. Consultado el 29 de septiembre de 2020 en https://www.medicalcountermeasures.gov/app/barda/coronavirus/COVID19.aspx ; Portafolio de vacunas COVID-19 de CEPI, consultado el 29 de septiembre de 2020 en https://cepi.net/COVAX/
Referencias: https://lozierinstitute.org/a-visual-aid-to-viral-infection-and-vaccine-production/.